В 2011 г. в арсенале врачей появилось 2 новых препарата для лечения хронического гепатита С (ХГС). Препараты боцепревир (BOC) и телапревир (TVR) являются лекарственными средствами прямого противовирусного действия – ингибируют протеазу NS3 вируса гепатита С (ВГС).
Проведенные исследования показали высокую эффективность терапии больных ХГС с генотипом 1 ВГС, ранее не получавших лечения, схемой, включавшей комбинацию пегилированного интерферона (ПегИФН) и рибавирина (РБВ) с ингибиторами протеазы BOC или TVR [частота устойчивого вирусологического ответа (УВО) – 67–70%] [1, 2].
В течение 2012 г. схемы терапии ХГС, содержащие препараты TVR и BOC, были включены в рекомендации по лечению больных ВИЧ-инфекцией, имеющих сочетанную инфекцию с ВГС (DHHS, IAS, EACS) [3–5]. В декабре 2012 г. препарат телапревир был зарегистрирован на территории России для лечения больных ХГС с генотипом 1 ВГС.
Рекомендации по применению препарата TVR у пациентов с сочетанной патологией основаны на результатах протокола 110, являющегося исследованием 2-й фазы и посвященного оценке эффективности и безопасности ингибитора протеазы ВГС TVR в сочетании с ПегИФН и РБВ у больных ХГС (генотип 1) и ВИЧ-инфекцией, ранее не получавших лечения ХГС [6].
В исследование 110 были включены 60 больных с сочетанной инфекцией (ВИЧ/ВГС), которым была назначена терапия ХГС, включавшая TVR, ПегИФН-альфа2а и РБВ (ТПР), или стандартное лечение ХГС – ПегИФН-альфа2а + РБВ (ПР) [7]. Все пациенты были разделены на 2 группы: в первую (группа А) включили пациентов, не получавших антиретровирусной терапии (АРВТ), во вторую (группа B) – пациентов, получавших АРВТ. Схема АРВТ включала тенофовир (ТDF), эмтрицитабин (FTC) или ламивудин (3TC) в сочетании либо с эфавирензом (EFV), либо с усиленным ритонавиром атазанавиром (АТV/r).
Пациентам, не получавшим АРВТ или получавшим АТV/r, TVR назначали внутрь в дозе 750 мг х 3 раза в сутки, а пациентам, получавшим EFV – в дозе 1125 мг каждые 8 часов.
Через 4 нед лечения снижение уровня РНК ВГС ниже порога определения тест-системой [< 25 МЕ/ мл – быстрый вирусологический ответ (БВО)] было обнаружено у 68% больных, получавших ТПР, и ни у одного больного, получавшего ПР (рис. 1).
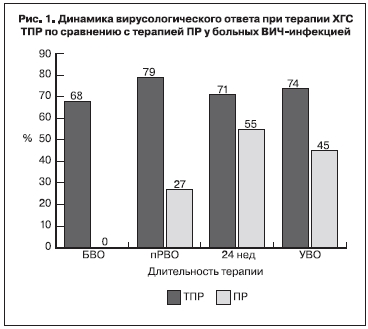
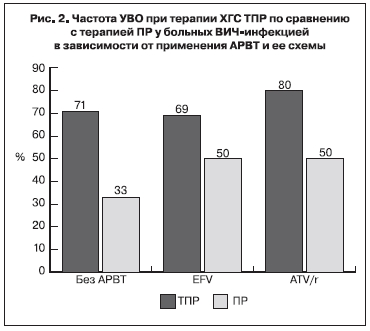
Неопределяемый уровень РНК ВГС через 12 нед терапии (полный ранний вирусологический ответ – пРВО) выявляли у 79% больных, получавших ТПР, и только у 27%, получавших комбинацию ПР. УВО (неопределяемый уровень РНК ВГС через 24 нед после окончания терапии ХГС) имел место у 74% больных группы ТПР и у 45% больных группы ПР. В группе А УВО был зарегистрирован у 71% больных, получавших ТПР, и у 33% больных, получавших ПР. У больных группы В максимальный результат УВО (80%) был выявлен у лиц, получавших ТПР, а в схеме АРВТ – ATV/r (рис. 2). У пациентов, получавших ТПР и EFV, результат раннего УВО был скромнее – 69%, тогда как у больных из группы сравнения (ПР) ранний УВО составил только 50% вне зависимости от назначения EFV или ATV/r [6]. У 10 (26%) из 38 больных, получавших TVR, была отмечена неудача лечения. У двух пациентов, получавших ТПР, терапия была остановлена через 4 и 8 нед, поскольку уровень РНК ВГC был > 1000 МЕ/мл. Повышение уровня РНК ВГC > 100 МЕ/ мл после снижения вирусной нагрузки до неопределяемых значений, либо повышение вирусной нагрузки на 1 log10 и более после достижения минимального уровня расценивали как вирусологический прорыв, который был определен у 4 больных (у 3 пациентов в процессе лечения и у 1 – после завершения терапии). 4 пациента из группы больных, получавших ТПР, не явились на очередной визит (выбыли из-под наблюдения) и были расценены как неудача лечения. Среди больных, получавших ПР, неэффективность лечения имела место более чем у половины (у 12 из 22) пациентов, при этом у 8 больных терапия была остановлена до ее окончания в связи с отсутствием эффекта [6].
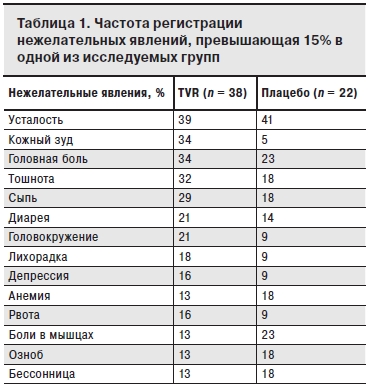
Частота развития нежелательных явлений (утомляемость, тошнота, гипертермия, головная боль) была выше в группе пациентов, получавших ТПР. У больных, получавших TVR, чаще наблюдали появление кожного зуда (34%) и сыпи (29%) от легкой до умеренной степени выраженности, что однако не привело к прекращению терапии (табл. 1). У 3 пациентов лечение ТПР было прекращено в связи с развитием нежелательных явлений: в одном случае из-за желтухи, в другом – из-за анемии и в третьем – из-за холецистолитиаза (все пациенты получали ATV/r) [6]. Поскольку минимальный уровень (Cmin) и AUC АТV повышаются при сопутствующем применении ТVR, при совместном введении обоих препаратов можно ожидать повышения уровня билирубина в крови преимущественно за счет свободной фракции. Кроме того, индуцированный РБВ гемолиз может еще больше способствовать развитию гипербилирубинемии.
На основании результатов исследования 110 и изучения лекарственных взаимодействий TVR и антиретровирусных препаратов в ноябре 2012 г. была опубликована версия 6.1 рекомендаций Европейского клинического общества по СПИДу (EACS), 4-я часть которых посвящена проблеме хронических вирусных гепатитов у больных ВИЧ-инфекцией [3].
У больных с сочетанной инфекцией (ВИЧ-инфекция и ХГС) тактику терапии выбирают, исходя из сведений о предшествующем лечении, состоянии пациента и количестве CD4+-лимфоцитов (табл. 2).
* Динамика содержания CD4-клеток и вирусной нагрузки.
Поскольку у больных ВИЧ-инфекцией и ХГС имеет место более быстрое (по сравнению с моноинфекцией ВГС) прогрессирование фиброза печени, терапия ХГС показана всем пациентам с ВИЧ-инфекцией, у которых обнаруживают репликацию ВГС (РНК ВГС). Для больных ХГС с генотипами 2, 3 и 4 ВГС терапевтической схемой выбора является сочетание ПегИФН и РБВ. Суточную дозу РБВ назначают в зависимости от массы тела пациента: 1000 мг/сутки при массе тела ≤ 75 кг и 1200 мг/ сутки при массе тела > 75 кг [3, 8–10].
У больных ХГС с генотипом 1 ВГС выбор терапевтического режима зависит от наличия у пациента одновременно нескольких положительных прогностических критериев достижения УВО: низкого уровня РНК ВГС (< 400 000 – 500 000 МЕ/мл), отсутствия выраженного фиброза печени (< F2 по шкале Metavir), отсутствия инсулинорезистентности, наличия генотипа CC интерлейкина 28В (ИЛ-28В). Если у пациента с сочетанной инфекцией (ВИЧ-инфекция и ХГС) с генотипом 1 ВГС присутствует весь спектр положительных прогностических критериев УВО, то в качестве терапевтической схемы можно использовать комбинацию ПегИФН и РБВ. Для расчета вероятности достижения УВО при терапии ПегИФН и РБВ можно использовать электронный калькулятор «Прометей», представленный на сайте www.fundacionies/prometheusindex.php. При определении вероятности достижения УВО в электронный калькулятор необходимо ввести данные пациента: генотип ИЛ-28В, генотип ВГС, выраженность фиброза печени в kРа (по данным эластографии) и уровень РНК ВГС (log10 МЕ/мл). Наличие положительных прогностических критериев УВО, а также БВО (неопределяемый уровень РНК ВГС через 4 нед терапии ХГС) могут служить основанием для сокращения длительности терапевтического курса (до 24 нед). Отсутствие БВО определяет необходимость увеличения длительности курса лечения ПегИФН и РБВ (у больных генотипами 2 и 3 ВГС до 48 нед, у больных генотипами 1 и 4 – до 72 нед). Если через 12 нед лечения не достигнут ранний вирусологический ответ (РВО – снижение РНК ВГС минимум на 2 log10 по сравнению с исходным уровнем) при лечении ПегИФН и РБВ, терапия должна быть прекращена. Также лечение должно быть прекращено, если через 24 нед терапии сохраняется репликация РНК ВГС.
При отсутствии одного или нескольких положительных критериев достижения УВО у больных с сочетанной инфекцией (ВИЧ-инфекция и ХГС) с генотипом 1 ВГС для лечения ХГС рекомендуется применять комбинированную терапию, включающую ингибитор протеазы ВГС (TVR или BOC) в сочетании с ПегИФН и РБВ.
TVR назначают в дозе 750 мг каждые 8 часов. Длительность терапии комбинацией TVR, ПегИФН и РБВ составляет 12 нед, далее в течение 36 нед используют только ПегИФН и РБВ [3, 8, 10].
В случае терапевтического эффекта через 4 нед тройной терапии (РНК ВГС < 1000 МЕ/мл), лечение тремя препаратами продолжают до 12 нед. Если через 12 нед терапии уровень РНК ВГС по-прежнему < 1000 МЕ/мл, лечение ПегИФН и РБВ продолжают до 24 нед. Если через 24 нед терапии РНК ВГС не обнаруживают, лечение по указанной схеме следует продолжить еще на 24 нед (общая продолжительность терапии ХГС составляет 48 нед) [3, 8,10].
В Европейских рекомендациях (EACS, версия 6.1, ноябрь 2012) предложен алгоритм выбора схемы лечения ХГС у больных ВИЧ-инфекцией (при наличии генотипа 1 ВГС) в зависимости от выраженности фиброза печени, проводимой ранее терапии ХГС и ее результатов (рис. 3) [3].
Если больной с сочетанной инфекцией (ВИЧ/ВГС) с генотипом 1 ВГС ранее не получал лечения ХГС, то при отсутствии или минимальной выраженности фиброза печени (F0–F1 по шкале Metavir) назначение противовирусной терапии может быть отложено. При этом необходимо ежегодно осуществлять контроль стадии фиброза, желательно с помощью двух одобренных методов (эластография печени + сывороточные маркеры фиброза, либо гистологическое исследование биоптата печени). При быстром прогрессировании фиброза показано применение трехкомпонентной терапии, включающей ингибитор протеазы ВГС.
При наличии более выраженного фиброза (F2 и более) или компенсированного цирроза печени (стадия А по Чайлду–Пью) пациенту целесообразно назначить трехкомпонентную терапию ХГС.
Для пациентов, уже получавших терапию ПегИФН и РБВ, но у которых не было УВО, решение о лечении следует принимать на основании стадии фиброза и результатов ранее проводимой терапии (см. рис. 3). При наличии у больного рецидива репликации ВГС после завершения курса терапии ХГС и стадии фиброза F2 и более следует провести повторный курс лечения ХГС тремя препаратами, включая ингибитор протеазы ВГС. Если фиброз отсутствует или выявлена легкая стадия фиброза (F0–F1), решение о проводимом лечении должно приниматься индивидуально.
Пациентам, ранее не ответившим на стандартную терапию (ПегИФН + РБВ), при отсутствии, легком (F0–F1) или даже значительном (F2–F3) фиброзе не следует назначать трехкомпонентную терапию из-за высокого риска неблагоприятного результата и развития резистентности ВГС к ингибиторам протеазы. Однако у этих пациентов требуется ежегодно оценивать стадию фиброза для выявления прогрессирования заболевания. При наличии компенсированного цирроза печени (F4, стадия А по Чайлду–Пью) пациентам показана трехкомпонентная терапия, однако при ее назначении необходим индивидуальный подход.
При назначении терапии ХГС препаратами ПегИФН и РБВ необходимо учитывать лекарственные взаимодействия некоторых нуклеозидных ингибиторов обратной транскриптазы ВИЧ (НИОТ) с РБВ. Не рекомендуется сочетание РБВ с зидовудином – ZDV (увеличивается частота развития анемии), диданозином – ddI (повышается вероятность декомпенсации заболевания печени) или ставудином – d4T (повышается вероятность развития стеатоза печени). Абакавир (ABC) и РБВ являются производными одного нуклеозида и конкурируют в процессе фосфорилирования, что нивелируется при назначении РБВ в дозе не менее 13,6 мг/кг [3, 4, 9, 11].
Оптимальным сочетанием НИОТ является TDF + ламивудин (3TC) или эмтрицитабин (FTC) в стандартных дозировках. При невозможности применять TDF, если у пациента нет анемии, назначают фосфазид (Ф-АЗТ) или АВС. При наличии анемии (гемоглобин < 95 г/л) препаратом выбора является АВС [9, 11].
Существуют лекарственные взаимодействия между антиретровирусными препаратами и TVR. Исследование взаимодействия TVR (750 мг каждые 8 часов) и «усиленных» ритонавиром ингибиторов протеазы ВИЧ [ATV/r, DRV/r, фосампренавира (FPV/r), LPV/r] у здоровых добровольцев позволило обнаружить минимальные влияние ATV/r на AUCtau и Cmin TVR (0,80 и 0,85 соответственно), при этом AUCtau и Cmin ATV/r увеличивались на 1,17 и 1,85 соответственно [7]. Применение других ингибиторов протеазы ВИЧ приводило к снижению показателей TVR до 0,46–0,70. Также снижались параметры DRV/r и FPV/r (0,44–0,60). При сочетании EFV и TVR дозировку последнего увеличивали до 1125 мг при приеме каждые 8 часов или до 1500 мг через каждые 12 часов. Не обнаружено лекарственных взаимодействий между TVR и ингибитором интегразы ВИЧ ралтегравиром (RAL), НИОТ этравирином (ETR) и рилпивирином (RPV) [7].
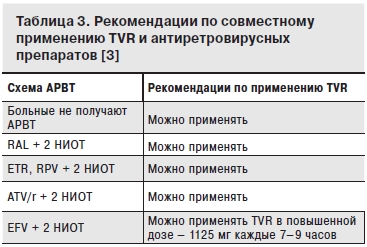
Рекомендации по выбору схемы АРВТ при необходимости одновременного лечения ВИЧ-инфекции и ХГС комбинацией, включающей TVR, представлены в табл. 3.
Таким образом, в современных рекомендациях представлен дифференцированный подход к терапии ХГС у больных ВИЧ-инфекцией. При наличии ряда положительных прогностических критериев (генотип СС ИЛ-28В, исходный уровень РНК ВГС < 400000 – 500 000 МЕ/мл, отсутствие выраженного фиброза печени) больным ВИЧ-инфекций и ХГС с генотипом 1 ВГС возможно назначение традиционной схемы лечения, включающей ПегИФН и РБВ. Вероятность достижения УВО у таких пациентов может превышать 80%. Появление в клинической практике препаратов из группы ингибиторов протеазы ВГС существенно повышает вероятность достижения УВО при терапии ХГС у больных с сочетанной инфекцией (ВИЧ/ВГС), имеющих генотип 1 ВГС, даже при отсутствии полного спектра положительных прогностических критериев. Применение в схеме терапии больных ХГС с генотипом 1 ВГС TVR в сочетании с ПегИФН и РБВ увеличило частоту УВО у больных ВИЧ-инфекцией до 74%, тогда как при использовании стандартной схемы лечения (ПегИФН + РБВ) частота УВО не превышала 45%. Переносимость терапии TVR + ПегИФН + РБВ была удовлетворительной, только у 3 из 38 пациентов лечение было остановлено из-за развития нежелательных явлений.
Поскольку между АРВП и препаратами для лечения ХГС существуют лекарственные взаимодействия, лечение ХГС больному ВИЧ-инфекцией следует начинать, пока у пациента отсутствуют показания к назначению АРВТ. При необходимости одновременной терапии ХГС и ВИЧ-инфекции лечение целесообразно начинать с АРВТ, при этом выбор препаратов для схемы АРВТ следует осуществлять с учетом лекарственных взаимодействий РБВ и TVR с рядом антиретровирусных препаратов.


