В настоящее время изучение связи воспаления и свертывания находится в центре внимания научных клинических исследований, так как дисфункция эндотелия сосудов, связывающая эти два патологических процесса, является ранним патофизиологическим признаком и независимым предиктором неблагоприятного прогноза большинства заболеваний. Предотвращение эндотелиальной дисфункции микроциркуляторного русла является профилактикой и лечением многих заболеваний [1–3].
Рожа (erysipelas) как острое инфекционное заболевание распространена повсеместно и не зависит от уровня индустриального развития и социальной защищенности населения в разных странах. Важными патогенетическими аспектами развития этого заболевания являются общие и местные факторы предрасположенности. Рожа нижних конечностей часто встречается в сочетании с ожирением, сахарным диабетом 2-го типа, хронической венозной недостаточностью и микозами стоп и ногтей [4–7]. Рожа лица часто развивается в ассоциации с отомикозом и хроническими заболеваниями ЛОР-органов [8].
Несмотря на современные методы лечения, до 10% случаев рожи осложняются развитием некрозов кожи на участках образования геморрагий и пузырей, венозной несостоятельностью (перифлебиты, флебиты, тромбофлебиты). Регистрируется нарастание частоты геморрагических форм рожи [9–15]. С этих точек зрения изучение системы гемостаза и реологии крови в динамике течения инфекционного процесса у больных рожей нижних конечностей и рожей лица является актуальным.
Цель работы – изучение изменений системы гемостаза и реологии крови в динамике течения инфекционного процесса у больных рожей нижних конечностей и рожей лица и обоснование целесообразности заместительной и/или антитромботической терапии.
Материалы и методы
Обследовано 60 человек в возрасте от 25 до 71 лет, из них 36 с диагнозом «рожа нижних конечностей II степени тяжести» и 24 с диагнозом «рожа лица II степени тяжести». В 67% наблюдений отмечена первичная форма заболевания. Эритематозная форма рожи была установлена в 33% всех наблюдений (при роже лица – в 52%), эритематозно-буллезная – в 15%, эритематозно-геморрагическая – в 22% и буллезно-геморрагическая – в 30%. Эритематозно-геморрагическая (11 случаев) и буллезно-геморрагическая (15 случаев) формы рожи развивались на нижних конечностях чаще, чем на лице (2 и 3 случая соответственно). Риск развития геморрагических нарушений был достоверно выше при местном воспалительном процессе на нижних конечностях (78%) по сравнению с лицом (20%); отношение шансов (ОШ) = 9,9 [2,8; 34,7].
Первичная рожа лица диагностирована в 92% случаев преимущественно у женщин (16 женщин, 8 мужчин). При роже нижних конечностей случаи первичной рожи были зарегистрированы в 50% случаев, повторной – в 31% и рецидивирующей – в 19%; при роже лица – соответственно в 92, 4 и 4% случаев. Риск рецидива заболевания был статистически достоверно выше при локализации воспалительного очага на ногах по сравнению с лицом; ОШ = 5,55 [1; 51,2] (p = 0,009).
При роже нижних конечностей гендерное соотношение было сопоставимым: 17 мужчин и 19 женщин. Среди сопутствующих заболеваний обращала на себя внимание высокая (88%) частота микозов стоп и онихомикозов. У 11 больных было ожирение 2–4-й степени, у 5 – субкомпенсированный сахарный диабет 2-го типа.
У 37,5% больных рожей лица фоновая патология была представлена кожными заболеваниями (заушный дерматит, стрептодермия, псориаз), у 29% – хронической ЛОР-патологией (отит, тонзиллит, ринит). У 4 пациентов был сахарный диабет 2-го типа.
Пациенты находились на стационарном лечении в отделении рожи инфекционной клинической больницы № 2 г. Москвы. 32 больным назначена антибактериальная монотерапия: бензилпенициллина новокаиновая соль по 0,6 млн МЕ 2 раза в сутки внутримышечно в течение 7–10 дней и еще 2 больным – цефалоспорины (цефазолин) по 1 г 3 раза в сутки внутримышечно в течение 5 дней. Комбинированная терапия из двух антибиотиков (бензилпенициллина новокаиновая соль по 0,6 млн МE 2 раза в сутки внутримышечно в течение 7–10 дней и ципролет по 0,5 г 2 раза в сутки per os в течение 10 дней) проведена 14 больным. 12 человек получали комбинацию из трех антибиотиков (бензилпенициллина новокаиновая соль по 0,6 млн МЕ 2 раза в сутки в течение 7 дней + ципрофлоксацин 800 мг в сутки внутривенно в течение 3 дней с последующим переводом на 1 г в сутки per os в течение 10 дней + цефазолин 1 г 3 раза в сутки внутримышечно в течение 5 дней). Дополнительно пациенты получали антигистаминные препараты (зодак, диазолин), местную физиотерапию: ультрафиолетовое облучение (УФО) и токи низкой частоты (ТНЧ) – при роже лица, УВЧ, ТНЧ и магнитотерапию – при роже нижних конечностей. Очаг рожистого воспаления на нижних конечностях регулярно обрабатывали дубящим раствором перманганата калия. Пациентам, участвующим в исследовании, не назначали дополнительных препаратов, которые могли бы повлиять на состояние гемостаза.
Средний срок пребывания в стационаре больных рожей нижних конечностей составил 11,9 ± 4,1 дня, рожей лица – 8,4 ± 1,6 дня.
Исследование показателей гемостаза проводили в начале заболевания (1–3-й дни болезни) – 1-я точка исследования, в динамике (4–6-й и 7–10-й дни болезни) – 2-я и 3-я точки и в периоде реконвалесценции (11–15-й день болезни) – 4-я точка. Каждому третьему больному рожей нижних конечностей проводили катамнестическое исследование (через 5 мес. после выписки из стационара), позволяющее разграничить изменения, вызванные рожей, от фона сопутствующих заболеваний.
Контрольная группа состояла из 32 здоровых лиц в возрасте от 24 до 50 лет с равным соотношением мужчин и женщин.
Статистическую обработку полученных результатов проводили с помощью программы Statistica 10.0 for Windows 7.0. Для оценки статистически значимых (достоверных) различий между группами использовали следующие методы: количественные показатели, 2 независимые группы – метод Манна–Уитни; более 2 независимых групп – метод Краскела–Уоллиса; количественные показатели, связанные группы (до и после лечения, в динамике) – критерий Вилкоксона; качественные показатели – метод χ2, при необходимости – двусторонний точный критерий Фишера. Различия при использовании параметрических и непараметрических методов считали статистически значимыми при вероятности > 95% (p < 0,05). В случае статистически значимых различий между группами вычисляли ОШ и 95% доверительный интервал (ДИ): (ОШ [-95% ДИ; +95% ДИ]) [16].
Лабораторное исследование биохимических показателей, параметров коагулограммы, а также определение электрофоретическим способом белковых фракций в сыворотке крови проведено совместно с врачами экспресс-лаборатории инфекционной клинической больницы № 2; определение уровня протеина С выполнено в экспресс-лаборатории детской городской клинической больницы № 13 им. Н.Ф. Филатова. Исследование агрегационных свойств тромбоцитов, эластичности и деформабельности эритроцитов, а также определение уровня фактора фон Виллебранда (fvV)проведено в лаборатории гемостаза клинического отдела Центрального НИИ эпидемиологии Роспотребнадзора.
Агрегационная способность тромбоцитов (по методу Born) и эритроцитов (по оригинальной методике Ю.А. Шереметьева и соавт. [17]) определена фотометрическим способом на агрегометрах SOLAR AP 2110 (ЗАО «Солар», Республика Беларусь) и LA 230 (НПО «БИОЛА», Россия).
В качестве индуктора агрегации тромбоцитов применяли 2 х 10-5 М АДФ («Reanal», Венгрия), эритроцитов – 1% раствор протамина сульфата (ПС; ООО «Эллара», Россия) и водный раствор хлористого лантана (LaCl3; ОАО «Химик», Россия): 150 мг реактива разводили в 100 мл воды.
Турбодиметрическим способом на автоматическом коагулометре ACL ELITE PRO («Instrumentation Laboratory», США) определяли показатели внешнего пути свертывания [протромбиновое время, международное нормализованное отношение (МНО), протромбин по методу Квика] и внутреннего пути свертывания (активированное частичное тромбопластиновое время – АЧТВ). Степень дисфибриногенемии оценивали по тромбиновому времени, функциональной активности фибриногена (по методу Клауса) и по содержанию D-димера.
Эндотелиальная дисфункция определялась по степени атромбогенности эндотелия сосудистой стенки [уровни антитромбина III (АТ III) и протеина С] и адгезивным свойствам эндотелия (по fvW). Уровень АТ III в плазме крови определяли на автоматическом коагулометре ACL ELITE PRO; протеина С – на автоматическом коагулометре SYSMEX CA-500 («Siemens Healthcare Diagnostics», США; реагенты «Siemens AG», Германия). fvW определяли мануальным способом (1982), с помощью реактива НПО «Ренам» (Россия).
Белковые фракции в сыворотке крови исследовали электрофоретическим способом на агарозном геле в анализаторе Hydrasys («Sebia», Франция).
Уровень воспалительной реакции оценивали по содержанию С-реактивного белка (СРБ) на анализаторе HITACHI 902 («Roche Diagnostics GmbH», Германия–Япония). На этом же анализаторе определяли содержание трансферрина, церулоплазмина и гаптоглобина, ЛДГ и ЛДГ-1,2 в сыворотке крови. Согласно дизайну исследования определяли субстраты и ферменты биохимического паспорта [18, 19], оценивали клинические анализы крови и мочи.
Результаты и обсуждение
Нарушения системы гемостаза при остром инфекционном процессе могут трансформироваться в скрытую или явную картину диссеминированного внутрисосудистого свертывания (ДВС) с угрозой развития венозных тромбозов. Триггером механизмов развития венозных тромбозов служат повреждение тканей (в данном случае – инфекционное воспаление, вызываемое β-гемолитическим стрептококком), отек пораженной конечности, наличие лимфостаза и хронической венозной недостаточности, избыток и/или гиперактивность плазменных факторов. Все вышеперечисленные факторы усугубляют существующую дисфункцию эндотелия сосудистой стенки. Поэтому изучению атромбогенных и адгезивных свойств сосудистой стенки и контролю уровня естественных антикоагулянтов (протеина С и АТ Ш) уделяется пристальное внимание [20–26].
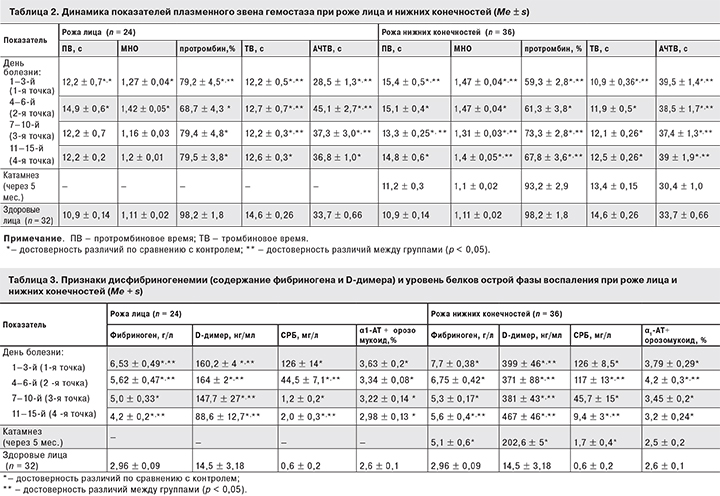
Исходный уровень протеина С в 1–3-й день болезни (при поступлении) в группе больных рожей нижних конечностей был ниже (81,9 ± 4,9%), чем у больных рожей лица (94,1 ± 6,0%) и достоверно ниже контрольных значений (100 ± 5%; р < 0,05) (табл. 1).
По мере угасания рожистого очага уровень протеина С постепенно восстанавливался в обеих группах.
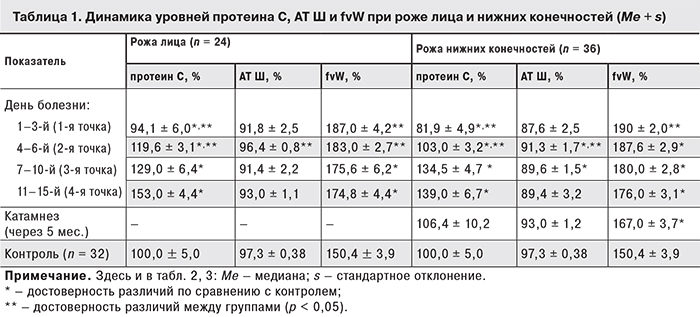
У больных рожей нижних конечностей без хронической венозной недостаточности (ХВН; n = 28) уровень протеина С был 99,8 ± 4,7% в остром периоде болезни и увеличился до 140,0 ± 4,5% в стадии реконвалесценции (р < 0,001; рис. 1). При роже нижних конечностей с ХВН исходно низкий уровень протеина С (69,8 ± 8,1%) статистически значимо не менялся в периоде реконвалесценции (79,15 ± 4,0%; р = 0,21) и оставался рефрактерно-низким на фоне проводимых лечебных мероприятий.
 Восстановление уровня протеина С до нормы наблюдалось на 3-й неделе болезни при роже лица (108,2 ± 5,1% при поступлении и 144,0 ± 4,6% при выписке; р1–4 < 0,001), на 4-й неделе – при роже нижних конечностей без ХВН (99,8 ± 4,7 и 140 ± 4,4% соответственно; р1–4 < 0,001) и отсутствовало у пациентов с рожей нижних конечностей и ХВН (69,8 ± 8,1 и 79,15 ± 4,07% соответственно; р1–4 = 0,21) (см. рис. 1).
Восстановление уровня протеина С до нормы наблюдалось на 3-й неделе болезни при роже лица (108,2 ± 5,1% при поступлении и 144,0 ± 4,6% при выписке; р1–4 < 0,001), на 4-й неделе – при роже нижних конечностей без ХВН (99,8 ± 4,7 и 140 ± 4,4% соответственно; р1–4 < 0,001) и отсутствовало у пациентов с рожей нижних конечностей и ХВН (69,8 ± 8,1 и 79,15 ± 4,07% соответственно; р1–4 = 0,21) (см. рис. 1).
На общем фоне эндотелиальной дисфункции уровень протеина С у отдельных больных значительно возрастал в периоде реконвалесценции (с 1-й по 4-ю точку исследования соответственно с 49,7 до 112%, прирост – 125%; с 48,9 до 110,7%, прирост – 126%; с 65,5 до 119,7%, прирост 83%), что заслуживает внимания как эффективный пример работы механизмов саморегуляции гомеостазаи (рис. 2, см. на вклейке).
Период реконвалесценции у больных рожей нижних конечностей без признаков ХВН (с положительной динамикой уровня протеина С) протекал более благоприятно, чем у больных рожей нижних конечностей с сопутствующей ХВН. Некоторые авторы [4, 13–15, 26] отмечают, что при ХВН увеличиваются сроки заживления очага рожистого воспаления и затягивается период реконвалесценции. Нам удалось доказать, что при нормальном уровне протеина С (100 ± 5%) шансы благоприятного течения рожи нижних конечностей достоверно выше (ОШ = 2,89, [0,15; 55]), чем при низком уровне протеина С и сопутствующей ХВН.
Оценивали также уровень другого, не менее значимого, естественного антикоагулянта – АТ III. Согласно литературным источникам [13, 25, 27– 29], тромбозы (инсульты, инфаркты) развиваются при снижении уровня АТ Ш до 80–90%. Дефицит АТ Ш развивается при клинических проявлениях ДВС и синдроме полиорганной недостаточности.
При роже нижних конечностей дефицит АТ Ш был более выраженым, чем при роже лица (см. табл. 1). Его исходные значения при роже нижних конечностей (87,6 ± 2,5%) были достоверно ниже, чем при роже лица (91,8 ± 2,5%) и по сравнению с контролем (p < 0,05) и не восстанавливались вплоть до выписки из стационара. Более выраженный дефицит АТ Ш у больных рожей нижних конечностей способен объяснить более высокую частоту геморрагических форм заболевания, чем при роже лица (78 и 22% соответственно). Кроме того, АТ Ш (как и фибриноген, СРБ, орозомукоид) относится к острофазовым белкам. Ранее проведенные нами исследования показали, что уровень белков острой фазы воспаления был выше у больных рожей нижних конечностей в сравнении с рожей лица [6, 22].
Содержание α2-макроглобулина (α2-МГ) снизилось на 25%. Уровень α2-МГ (ингибитора различных протеаз, в том числе плазмина) был минимальным в конце 1-й недели болезни: 3,78 ± 0,16% при роже лица и 3,96 ± 0,16% при роже нижних конечностей.
β-гемолитический стрептококк синтезирует целый ряд факторов патогенности (стрептокиназу, гиалуронидазу, стрептодорназу), которые разрушают защитный уровень гепарансульфата в эндотелии, выстилающем сосудистую стенку, что приводит к повышению протромбогенных свойств эндотелия (с высвобождением fvW и снижением активности АТ III) [9, 10, 12, 16, 27]. Повышение уровня fvW в интервале от 187 до 220% на 1-й неделе болезни мы наблюдали у всех больных рожей, независимо от локализации очага. По мере угасания очага воспаления наблюдалась тенденция к снижению высоких значений fvW, однако полной нормализации исследуемого параметра не наступило (см. табл. 1).
Таким образом, анализ результатов определения маркеров гемостатической функции эндотелия у больных рожей указывает на скомпрометированность у них эндотелий-зависимой регуляции гемостаза как по антитромботическим (снижение уровней протеина С и АТ III), так и по адгезивным (высокий уровень fvW) характеристикам. Дефицит естественных антикоагулянтов был более выражен при роже нижних конечностей. Обнаруженная нами рефрактерность протеина С у больных рожей нижних конечностей с ХВН в динамике лечения является диагностическим маркером ХВН и может служить показанием для назначения им заместительной сосудистой терапии [30 – 35].
Известно, что естественные антикоагулянты организм использует для изоляции (отграничения) зоны инфекционного воспаления, и снижение их содержания «открывает ворота» для генерализации инфекционного воспаления [29 –31].
У обследованных нами больных рожей лица и нижних конечностей по показателям внешнего (протромбиновое время, протромбиновый индекс, МНО) и внутреннего (АЧТВ) путей свертывания, по степени дисфибриногенемии (тромбиновое время, функциональная активность фибриногена и содержание D-димера) были обнаружены следующие сдвиги (табл. 2):
- активация каскада свертывания в остром периоде болезни [сокращение тромбинового времени при роже лица и нижних конечностей в 1–3-й день болезни по сравнению с контролем (p < 0,05)], что указывает на активные процессы тромбино- и фибринобразования в кровеносном русле;
- активация внешнего пути свертывания [увеличение протромбинового времени при роже нижних конечностей по сравнению с контролем (p = 0,033), уменьшение протромбинового индекса и повышение МНО];
- активация внутреннего пути свертывания [увеличение АЧТВ при поступлении и в периоде реконвалесценции при роже нижних конечностей. При роже лица исходное АЧТВ было сокращено по сравнении с контролем (p < 0,05) и увеличивалось к концу 1-й недели болезни (p = 0,025)];
- дисфибриногенемия [сокращение тромбинового времени с активацией процесса полимеризации фибрина и появления в крови большого количества D-димеров (табл. 3)]. Уровень фибриногена был выше у больных рожей нижних конечностей по сравнению с больными рожей лица: 8,0 ± 2,3 г/л против 5,9 ± 1,8 в 1–6-й день болезни (р = 0,008) и 6,6 ± 2,4 г/л против 4,3 ± 1,0 на 7–15–й день (р < 0,0001). Фибриноген относится к группе белков острой фазы воспаления, в которую входят AT Ш, СРБ, пресепсином, прокальцитонином, ФНО-α и ИЛ-6 [28, 29, 33, 36, 37].
Следовательно, степень дисфибриногенемии, активация внешнего и внутреннего путей свертывания были более выражены при локализации рожистого очага на нижних конечностях. Пик гемокоагуляционных изменений регистрировали на 4–6-й день болезни (2-я точка исследования; см. табл. 3).
Исходный уровень фибриногена при роже нижних конечностей (7,7 ± 0,38 г/л) был на 18% выше, чем при роже лица (6,53 ± 0,49 г/л), тогда как содержание в плазме D-димера различалось более чем в 2 раза (399 ± 46 и 160,2 ± 41 нг/мл соответственно) и в 27 раз (!) превышало контрольные значения (14,5 ± 3,18 нг/мл; р < 0,001).
Документально подтвержденные различия по уровню D-димеров в крови позволяют сделать вывод о том, что процессы внутрисосудистого свертывания при роже нижних конечностей протекают интенсивнее, чем при роже лица, поскольку необходимым условием повышения уровня D-димеров в крови служит наличие сгустков полимеризованного фибрина, внутри которых происходит превращение плазминогена в плазмин [28, 32, 35].
Повышение уровня D-димера и снижение уровня α2-МГ также свидетельствуют о мощной локальной активации протеолитических ферментов (плазмина, матриксных металлопротеиназ, эластазы нейтрофилов), которые разрушают экстрацеллюлярный матрикс и индуцируют процесс образования эрозий, язв и некрозов в очаге инфекционного воспаления [11, 28–31].
Со 2-й недели болезни содержание белков острой фазы воспаления [фибриногена, СРБ, α1-антитрипсина (α1-АТ) и орозомукоида] снижалось по мере улучшения состояния больных (см. табл. 3).
Обнаруженная дисфибриногенемия, активация внешнего и внутреннего путей свертывания, как и повышение содержания белков острой фазы воспаления, подтверждают существование тесной связи между системным воспалительным ответом и нарушениями гемостаза с взаимным усилением [1–3, 25, 28, 30, 33, 38].
Риск развития тяжелых (эритематозно-буллезной, эритематозно-геморрагической, буллезно-геморрагической) форм рожи на нижних конечностях также был выше, чем на лице (ОШ = 4,9[1,5; 16]).
В нормальных условиях циркулирующие тромбоциты не взаимодействуют с внутренней поверхностью сосуда, покрытой тонким слоем гепарансульфата, придающим атромбогенные и антиадгезивные свойства эндотелию кровеносных сосудов. При повреждении сосудистой стенки в кровоток экспонируются компоненты субэндотелия, главным из которых является коллаген, а при участии fvW (взаимодействие с рецепторами тромбоцитов GP1b) и фибриногена (c рецепторами тромбоцитов GPIIb/Ша) процессы адгезии и агрегации кровяных пластинок значительно ускоряются [27, 28, 39–42].
В наших наблюдениях АДФ-индуцированная агрегация тромбоцитов была минимальной в 1–3-й день болезни при роже лица (41,7 ± 4,0%) и роже нижних конечностей (64,8 ± 3,9%; p < 0,05), что статистически значимо ниже функциональной активности тромбоцитов у здоровых лиц (76,0 ± 3,1%; p < 0,05). На 11–15-й день болезни наблюдалась тенденция к восстановлению функциональной активности тромбоцитов (71,7 ± 3,4% при роже нижних конечностей и 59,0 ± 3,2% при роже лица). В обеих группах количество тромбоцитов выросло: с 224 ± 10 х 109/л до 408 ± 21 х 109/л (p = 0,002) при роже нижних конечностей и с 234 ± 30 х 109/л до 317 ± 29 х 109/л (p = 0,04) при роже лица. Следовательно, количество и функциональная активность тромбоцитов восстанавливаются при роже к концу 2-й недели болезни.
В то же время исходно нормальное содержание эритроцитов при поступлении (1-я точка исследования) снизилось на 7–10-й день болезни (2-я и 3-я точки исследования). Количество клеток уменьшилось на 7% от первоначальных значений (с 4,7 х 1012/л до 4,39 х 1012/л) при роже лица и на 5% (с 4,6 х 1012/л до 4,37 х 1012/л) при роже нижних конечностей. Одновременно COЭ достигла максимальных значений: 53,7 ± 8,5 мм/ч при роже нижних конечностей и 26,3 ± 5,8 мм/ч при роже лица (р = 0,006).
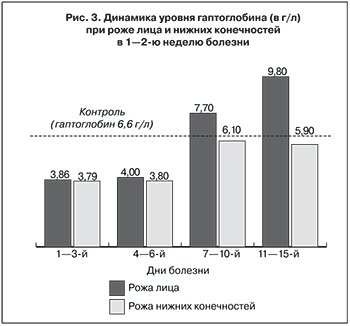
Учитывая описанное нами ранее повышение уровней непрямого билирубина и ЛДГ в крови больных рожей, а также установленное в настоящем исследовании снижение уровня гаптоглобина (3,86 ± 0,26 г/л при роже лица и 3,79 ± 0,3 г/л при роже нижних конечностей; p < 0,05 по сравнению с контролем) становится очевидным развитие скрытого гемолиза [6, 40, 43]. Данный вывод подтверждается последующей динамикой гаптоглобина, который рикошетом увеличивается на 153% от первоначальных значений при роже лица и на 61% – при роже нижних конечностей (рис. 3).
Следовательно, внутрисосудистый (скрытый) гемолиз выступает одним из ведущих патогенетических механизмов развития ДВС-подобного синдрома, который описывают как клинически стертый (локальный) ДВС-синдром [4, 11, 12, 14, 44, 45]. В наших наблюдениях у 3 (5%) из 60 обследованных больных ДВС-подобный синдром перерос в клинически выраженную картину ДВС-синдрома [40, 43].
Мы изучили изменения реологических свойств эритроцитов: их эластичности (агрегация с ПС) и деформабельности (агрегация с LaCl3) при роже.
У здоровых лиц степень эластичности и деформабельности кровяных шариков была почти равнозначной: 62,0 ± 4,9% на ПС и 66,4 ± 4,2% на LaCl3.
При роже эластичность клеток уменьшалась в 2 раза (агрегация с ПС), а деформабельность (агрегация с LaCl3) увеличивалась на 37% (рис. 4, см. на вклейке).
Записывая агрегационные кривые на агрегометре LA 230 (НПО «БИОЛА», Россия) одновременно на 2 разных типах индукторов (LaCl3 и ПС), мы обнаружили, что размеры агрегатов были в 3,6 раза крупнее, а степень агрегации – в 7,8 раз выше в на LaCl3 в сравнении с ПС.
При добавлении LaCl3 эритроциты больных рожей быстрее (3–5 мин.) взаимодействовали друг с другом, образовывали хлопья и быстро оседающие на дно пробирки крупные, видимые невооруженным глазом конгломераты [6, 40, 43].
Изменение конформационных свойств мембраны эритроцитов, трансформацию клеток из вогнуто-дисковидной формы в шарообразную заметили и другие исследователи [4, 14, 45]. Наши эксперименты доказывают, что при добавлении LaCl3 к эритроцитам больных рожей нарушается цитоархитектоника мембран клеток, что приводит к быстрому склеиванию их друг с другом и образованию крупных конгломератов. Агрегация с LaCl3 помогает воспроизвести in vitro картину скрытого гемолиза и повышенную «ломкость» эритроцитов у больных рожей.
Механизм действия ПС иной. Индуктор не вызывает конформационной перестройки мембраны, а постепенно, по мере осаждения на поверхностной мембране эритроцита собственных белков, меняет ее заряд. По мере утраты мембраной отрицательного заряда (который препятствует склеиванию клеток друг с другом) эритроциты начинают осаждаться в виде монетных столбиков. Агрегаты на ПС выглядят более мелкими и нежными, а скорость агрегации в несколько раз меньше – от 10 мин. [6, 40, 43].
Обнаруженные различия эластичности и деформабельности эритроцитов сохранялись и в периоде реконвалесценции. Высокая «хрупкость» мембраны эритроцитов сохранялась до конца 2-й недели болезни, а низкая «пластичность» – вплоть до выписки из стационара
Следует добавить, что эритроциты в крови выполняют не только кислородно-транспортную функцию, но и являются мощным буфером системы гемостаза и вторым по значимости (после альбумина) барьером детоксикации. Пул эритроцитов используется организмом для дополнительного восполнения белкового дефицита в кровеносном русле [8, 19, 40, 41, 46]. Дисковидная форма позволяет эритроциту максимально эффективно выполнять свои многочисленные функции, поэтому восстановление эластичности эритроцитов является важным фактором при проведении соответствующих лечебных мероприятий.
Выводы
- Положение о том, что рожа нижних конечностей в 3,9 раза чаще, чем рожа лица, осложняется геморрагическими проявлениями, подтверждено лабораторными исследованиями.
- Результаты определения маркеров гемостатической функции эндотелия у больных рожей указывают на скомпрометированность эндотелий-зависимой регуляции гемостаза как по антитромботическим (снижение уровней протеина С и АТ III), так и по адгезивным (высокий уровень fvW) характеристикам.
- Повышение уровня D-димера и снижение α2-МГ указыват на мощную активацию протеолитических ферментов (плазмина, матриксных металлопротеиназ, эластазы нейтрофилов), что патогенетически связано с образованием булл, эрозий и изъязвлений в очаге рожистого воспаления.
- Низкий уровень протеина С, не меняющийся при проведении стандартных лечебных мероприятий, не только является лабораторным индикатором хронической венозной недостаточности при роже нижних конечностей, но и служит маркером развития ДВС-подобного синдрома.
- Документально подтвержденный дефицит протеина С может быть показанием для решения вопроса о проведении противотромботической терапии. Начатая в максимально ранние сроки заместительная терапия (протеином С) может способствовать отграничению зоны воспалительного очага и уменьшению выраженности местных протеолитических реакций.
- Обнаружены признаки внутрисосудистого (скрытого) гемолиза и нарушения реологических свойств эритроцитов: повышение деформабельности (агрегация с LaCl3) и снижение эластичности (агрегация с ПС). Нарушение эластичности эритроцитов является показанием для добавления к стандартной терапии рожи препаратов, повышающих пластичность эритроцитов и улучшающих реологические свойства крови (пентоксифиллин).
- Риск развития геморрагических нарушений при роже нижних конечностей выше, чем при роже лица (ОШ = 9,88 [2,81; 34,7]).


