Цитомегаловирусная инфекция (ЦМВИ) впервые описана более 100 лет назад [1], но интерес к её изучению, в том числе к терапии заболевания, не ослабевает.
В настоящее время известно, что цитомегаловирус (ЦМВ) обладает преимущественно нейротропным, эпителитропным, гепатотропным и кардиотропным действием [2], что объясняет чувствительность к инфекции плода, полиморфизм клинической картины у ребенка после рождения, а также генерализованный характер заболевания [2–4]. При этом до сих пор отсутствуют единые подходы к лечению генерализованных форм ЦМВИ у детей первого года жизни. Лечение в острый период заболевания состоит из этиотропной и посиндромальной терапии [5–7]. Ни один из современных методов не позволяет полностью избавиться от вируса, который при попадании в организм человека остается в нем навсегда. Поэтому целью лечения ЦМВИ является устранение симптомов острой формы заболевания и удержание вируса в неактивном состоянии [2, 6]. Специфическая терапия ЦМВИ проводится только после верификации диагноза и должна подтверждаться данными клинических, иммунологических, вирусологических исследований. При тяжелой генерализованной форме ЦМВИ используют виростатические препараты: ганцикловир (цимевен), фоскарнет [5, 6]. Применение ганцикловира имеет возрастные ограничения, назначать препарат детям рекомендуется только в том случае, если польза от лечения превышает существенный риск. Известен способ лечения ЦМВИ фоскарнетом, цитотектом/неоцитотектом, пентаглобином [2, 5, 6]. Применяют также комплексные иммуноглобулины, ацикловир внутривенно капельно в дозе 5–10 мг на 1 кг массы тела каждые 8 ч, продолжительность курса составляет 5–10 дней [8].
Особый интерес вызывает лечение интерферонами (ИФН), поскольку противовирусный эффект – одно из основных их свойств [9]. ИФН являются важными модуляторами иммунитета при применении невысоких терапевтических доз, что позволяет отнести их к семейству регуляторных цитокинов [9]. Введение экзогенного ИФН позволяет обеспечить элиминацию инфекционного агента задолго до того, как собственные клетки начинают синтезировать эндогенный ИФН в достаточном количестве. Кроме того, поступление ИФН помогает разгрузить пораженные клетки и компенсировать их неспособность к продукции собственного ИФН в необходимых количествах. Ускоренная элиминация инфекционного агента при введении экзогенного ИФН сокращает сроки течения инфекционного процесса [9, 10]. Применение препаратов этиотропного действия, к которым, в первую очередь, относятся природные и рекомбинантные ИФН, является альтернативным методом лечения [10]. В педиатрии предложено использовать ИФН-α-2b в комплексе с высокоактивными антиоксидантами витаминами С и Е (виферон® производства ООО «Ферон», Россия), полученный методом генной инженерии1. Он обладает антивирусной, антипролиферативной и иммуномодулирующей активностью. Не имеет возрастных ограничений. Ректальный путь введения препарата не перегружает желудочно-кишечный тракт, позволяет обеспечить быструю доставку активных компонентов в кровь и, соответственно, быстрое наступление терапевтического эффекта. Для производства препарата применяется гипоаллергенная основа – масло какао, не используются красители и подсластители, что позволяет минимизировать риски развития аллергии.
Целью исследования было совершенствование лечения генерализованной ЦМВИ у детей раннего возраста при сочетанном введении ганцикловира и ИФН-α-2b в комплексе с витаминами С и Е.
Материалы и методы
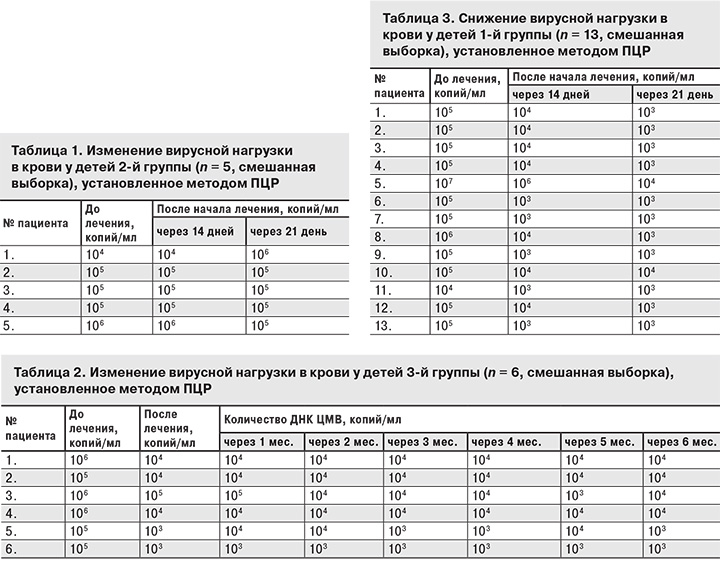
Исследование проводили на базе Инфекционной клинической больницы № 1 г. Ярославля и в Областном перинатальном центре с 2008 по 2016 гг. Критериями включения пациентов в исследование были возраст до 2 мес., постоянное проживание в Ярославле и Ярославской области, установленный диагноз генерализованной ЦМВИ. В исследование было включено 24 ребенка. Получено информированное согласие родителей на проведение специфической терапии. Диагноз ЦМВИ устанавливали на основании клинико-анамнестических и лабораторных данных: обнаружения ДНК ЦМВ в сыворотке крови, ликворе, слюне, моче; количественного определения ЦМВ в сыворотке крови методом полимеразной цепной реакции (ПЦР); наличия aнти-ЦМВ IgM, анти-ЦМВ IgG в сыворотке крови методом иммуноферментного анализа (ИФА), результатов биохимического анализа крови (уровень билирубина, АСТ, АЛТ, щелочной фосфатазы). Проводили УЗИ паренхиматозных органов и слюнных желез. Все дети осмотрены специалистами: оториноларингологом, неврологом, при необходимости – гематологом; наблюдались инфекционистом, неонатологом и иммунологом. Все пациенты были в возрасте до 2 мес., преобладали мальчики – 15 (62,5%), девочек было 9 (37,5%). У 24 детей выявлены симптомы гепатита, у 4 –энцефалита, у 3 – менингоэнцефалита, у 2 – пневмонии, у 8 – нефрита, у 6 – энтерита, у 3 – олангита. Были сформированы 3 группы пациентов. В 1-ю группу вошли 13 детей, получавших ганцикловир в течение 14–21 дня, затем ИФН-α-2b в комплексе с витаминами С и Е ректально; во 2-ю группу – 5 детей, у которых применяли только симптоматическое лечение ЦМВИ: гепатопротекторы, антибиотики широкого спектра действия (цефтриаксон, ампициллины) в возрастных дозировках (табл. 1). 3-ю группу составили 6 пациентов, получавших только ганцикловир (табл. 2). Все пациенты находились в лечебном учреждении с высоким уровнем диагностических и лечебных возможностей [11], а ежемесячное динамическое наблюдение инфекционист и педиатр осуществляли в амбулаторных условиях.
 Результаты
Результаты
Пациентам 1-й и 3-й групп при обнаружении положительной ДНК ЦМВ из крови в количестве 105 копий/мл и при любом количестве вируса в ликворе, наличии aнти-ЦМВ IgM или низкоавидных aнти-ЦМВ IgG по жизненным показаниям, на основании врачебного консилиума, заключения медицинской комиссии и информированного согласия родителей начинали лечение ганцикловиром из расчета 5–7,5 мг на 1 кг массы тела внутривенно 2 раза в сутки в течение 14–21 дня под контролем ПЦР крови и ликвора на ДНК ЦМВ. Препарат назначали на фоне таких проявлений ЦМВИ, как тромбоцитопения, анемия, нейтропения, что является противопоказанием для его применения. Но на фоне лечения ганцикловиром происходила нормализация гематологических показателей, что может служить подтверждением вирусного герпетического характера данных изменений.
У всех детей 1-й группы использование ганцикловира (табл. 3) в течение 14 дней способствовало снижению количества вируса в крови на 10–102 копий/мл, а через 21 день – на 102–103 копий/мл, но элиминации вируса ни у одного из пациентов достигнуто не было. После окончания курса терапии наблюдалась положительная клинико-лабораторная динамика: исчезновение менингиальных, очаговых симптомов, уменьшение размеров печени, селезенки; снижение вирусной нагрузки в крови до 104–103 копий/мл. Всех пациентов 1-й группы с 14–21-го дня переводили на лечение ИФН-α-2b в комплексе с витаминами С и Е (150 000 МЕ) ректально по оригинальной схеме: по 1 суппозиторию 2 раза в сутки в течение 10 дней, затем – 1 суппозиторий 3 раза в неделю (понедельник, среда, пятница) до достижения отрицательного результата ПЦР крови на ДНК ЦМВ. Контроль вирусной нагрузки методом ПЦР осуществляли 1 раз в месяц.
При положительной клинической динамике, стабильной прибавке веса, уменьшении вирусной нагрузки в клетках крови до 103–102 копий/мл детей выписывали на постоянное амбулаторное наблюдение специалистов при непрерывном применении ИФН-α-2b в комплексе с витаминами С и Е под контролем вирусной нагрузки ЦМВ в плазме крови.
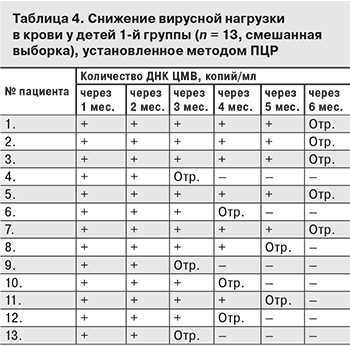
При последующем применении препарата по оригинальной схеме в течение 3–6 мес. (табл. 4) у всех детей происходила элиминация вируса из крови: через 3 мес. – у 3 (23%), через 4 мес. – у 3 (23%), через 5 мес. – у 2 (15,5%), через 6 мес. – у 5 (38,5%). При достижении элиминации вируса из крови (отрицательный результат ПЦР) лечение ИФН-α-2b в комплексе с витаминами С и Е прекращали. Рецидива ЦМВИ в 1-й группе не было ни у одного ребенка. Отмечена хорошая переносимость препаратов, отсутствие побочных реакций при контроле показателей клинического анализа крови.
У детей 3-й группы выделяли ЦМВ на протяжении всего периода наблюдения, то есть элиминации вируса из крови не наблюдалось, не происходило и перевода вируса в неактивное состояние. У этих пациентов сохранялись проявления гепатоспленомегалии, цитолиза в биохимическом анализе крови и сегментопении – в общем анализе крови (у 8–12%).
Вирусная нагрузка у больных 2-й группы при применении симптоматической терапии (см. табл. 3) не только не уменьшилась, но у 1 пациента увеличилась на 10–102 копий/мл, что свидетельствует о репликации вируса и продолжении инфекционного процесса. У 3 пациентов этой группы в возрасте 1 года был диагностирован детский церебральный паралич, у 1 ребенка в 5 мес. выявлена микроцефалия, еще у 1 – снижение слуха.
Таким образом, комбинированная терапия ганцикловиром, а в дальнейшем – ИФН-α-2b в комплексе с витаминами С и Е является определяющей при лечении генерализованной ЦМВИ у детей раннего возраста, так как позволяет достичь элиминации вируса из крови, ликвора и осуществить перевод вируса в пассивное состояние. Все пациенты находятся под катамнестическим наблюдением специалистов, им проводят динамическое количественное исследование ДНК ЦМВ в плазме крови.
Представленный способ лечения генерализованной ЦМВИ успешно используется в стационарах и поликлиниках Ярославля и Ярославской области.
Выводы
Новизна предлагаемого способа заключается в том, что для лечения генерализованной ЦМВИ у детей грудного возраста использована комбинированная схема: сочетание ганцикловира и введение ректально ИФН-α-2b (виферон®).
В течение 3–6 мес. была достигнута элиминация вируса из крови и ликвора и зарегистрирован переход вируса в пассивное состояние.
Данный подход к лечению генерализованной ЦМВИ у детей раннего возраста является эффективным и надежным, предупреждает развитие осложнений.


