Токсоплазмоз относится к паразитарным болезням, широко распространенным в мире. В России инвазировано 32–37% населения [1]. Возбудитель токсоплазмоза – Toxoplasma gondii (T. gondii) – способен длительно персистировать в разных органах и тканях. Для основной части человеческой популяции, инфицированной T. gondii, характерны латентные формы. Однако среди так называемых условно здоровых носителей, инвазированных T. gondii, может быть выявлена разнообразная клиническая микросимптоматика со стороны как центральной нервной системы, так и висцеральных органов. Выраженную клиническую картину заболевания имеют не более 10–20% инвазированных детей и взрослых. Как и при других оппортунистических паразитозах, вероятность манифестного развития токсоплазмоза существенно возрастает при иммунодефицитах любой этиологии. Особую значимость для специалистов, работающих с пациентами на фоне иммунодефицитных состояний, представляют случаи, когда реактивация латентной стадии токсоплазменной инфекции сопровождается высокой вероятностью летального исхода.
 Усиление интереса к проблеме токсоплазменной инфекции у реципиентов донорских органов в определенной мере связано с открытием трансплантационного токсоплазмоза. Оказалось, что при пересадке зараженного T. gondii донорского органа заболевание у реципиента на фоне иммуносупрессивной терапии развивается стремительно и в большинстве случаев без своевременной этиотропной терапии заканчивается смертью пациента [2]. Анализ данных литературы показал, что к настоящему времени к категории пациентов высокого риска развития токсоплазмоза относят реципиентов таких жизненно важных органов, как сердце, легкие, печень, почки. Отмечено, что пересадка сердца с цистами токсоплазм серонегативному пациенту чаще вызывает реактивацию инвазии по сравнению с пересадками легких, печени, почки, других тканей и клеток [3]. При трансплантации зараженного органа токсоплазмоз, как правило, развивается в течение первых полутора месяцев [4]. Активная форма токсоплазмоза как реактивация латентной инвазии у реципиентов чаще происходит в более отдаленные сроки (в среднем на 3–4-м месяце) и возможна на протяжении 7 лет после успешной трансплантации [5]. Нередко токсоплазмоз развивается после отмены препаратов, назначаемых в течение нескольких месяцев для профилактики оппортунистических инфекций. Анализ данных зарубежной литературы [4–8] свидетельствует о том, что, помимо диссеминированного токсоплазмоза, наиболее значимой среди клинических проявлений активного процесса у реципиентов жизненно важных органов является симптоматика токсоплазменного энцефалита, миокардитов и перикардитов, пневмоний, хориоретинита.
Усиление интереса к проблеме токсоплазменной инфекции у реципиентов донорских органов в определенной мере связано с открытием трансплантационного токсоплазмоза. Оказалось, что при пересадке зараженного T. gondii донорского органа заболевание у реципиента на фоне иммуносупрессивной терапии развивается стремительно и в большинстве случаев без своевременной этиотропной терапии заканчивается смертью пациента [2]. Анализ данных литературы показал, что к настоящему времени к категории пациентов высокого риска развития токсоплазмоза относят реципиентов таких жизненно важных органов, как сердце, легкие, печень, почки. Отмечено, что пересадка сердца с цистами токсоплазм серонегативному пациенту чаще вызывает реактивацию инвазии по сравнению с пересадками легких, печени, почки, других тканей и клеток [3]. При трансплантации зараженного органа токсоплазмоз, как правило, развивается в течение первых полутора месяцев [4]. Активная форма токсоплазмоза как реактивация латентной инвазии у реципиентов чаще происходит в более отдаленные сроки (в среднем на 3–4-м месяце) и возможна на протяжении 7 лет после успешной трансплантации [5]. Нередко токсоплазмоз развивается после отмены препаратов, назначаемых в течение нескольких месяцев для профилактики оппортунистических инфекций. Анализ данных зарубежной литературы [4–8] свидетельствует о том, что, помимо диссеминированного токсоплазмоза, наиболее значимой среди клинических проявлений активного процесса у реципиентов жизненно важных органов является симптоматика токсоплазменного энцефалита, миокардитов и перикардитов, пневмоний, хориоретинита.
Несмотря на важность темы, в литературе практически отсутствуют публикации, связанные с проблемой токсоплазмоза в отечественной трансплантологии.
Целью настоящей работы является анализ результатов собственных исследований, связанных с оценкой встречаемости маркеров инвазированности и остроты токсоплазмоза у реципиентов солидных органов.
Материалы и методы
Материалом для лабораторных исследований служили образцы сывороток крови (п = 58), полученные при плановых клинико-лабораторных исследованиях у пациентов, прооперированных в Федеральном научном центре трансплантологии и искусственных органов им. академика В.И. Шумакова Минздрава России в 2014–2015 гг. Основную группу составили 46 реципиентов, обследованных в разные сроки после ортотопической трансплантации сердца (ОТТС). Возраст пациентов основной группы колебался от 15 до 68 лет (средний возраст – 41,5 года). Дополнительная группа была представлена 12 пациентами в возрасте от 7 месяцев до 6 лет (средний возраст – 3 года), обследованными в разные сроки после трансплантации фрагмента родственной печени (ТФРП). Материалом для сравнения служили аликвоты сыворотки крови условно здоровых лиц – 351 донора крови. Для оценки инвазировности определяли антитела классов IgG, IgM и IgA к Toxoplasma gondii. Антитела IgG и IgM выявляли с помощью тест-систем ИФА ТоксоплаСтрип G и ТоксоплаСтрип М (ТУ-9398-005-4037-1634-2008) производства ЗАО «НИАРМЕДИК-ПЛЮС», Россия. Антитела IgA выявляли с применением тест-системы ВектоТоксо-IgA (ЗАО «ВЕКТОР-БЕСТ», Россия). Для оценки достоверности различий показателей инвазированности использовали принятый в эпидемиологии показатель – доверительный коэффициент, рассчитываемый с помощью ошибки репрезентативности [9].
Результаты и обсуждение
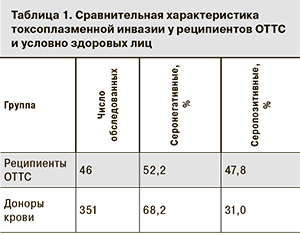
 При обследовании в сыворотке крови реципиентов основной группы выявлено наличие антител IgG к T. gondii. Сравнение показателей инвазированности T. gondii реципиентов ОТТС (47,8%) и условно здоровых жителей Москвы (31%) с помощью расчета ошибки репрезентативности показало статистическую значимость увеличения инвазированности реципиентов основной группы в сравнении с фоновыми показателями (табл. 1).
При обследовании в сыворотке крови реципиентов основной группы выявлено наличие антител IgG к T. gondii. Сравнение показателей инвазированности T. gondii реципиентов ОТТС (47,8%) и условно здоровых жителей Москвы (31%) с помощью расчета ошибки репрезентативности показало статистическую значимость увеличения инвазированности реципиентов основной группы в сравнении с фоновыми показателями (табл. 1).
Особый интерес, на наш взгляд, представляют результаты сравнительного анализа уровней IgM и IgA – маркеров острой инвазии, свидетельствующих об активности токсоплазмоза. Показано, что уровень остроты инвазии T. gondii в популяции условно здоровых доноров составляет 0,8%. При исследовании крови реципиентов ОТТС маркеры острой инвазии выявлены у 19,6% обследованных, при этом в 5 случаях обнаружены специфические антитела IgA, в 3 – IgM и в 1 случае – IgM и IgA. Важно отметить, что показатель остроты инфекции у реципиентов ОТТС на порядок выше, чем у здоровых доноров крови. Немаловажным обстоятельством является выявленная в процессе исследования тенденция увеличения частоты встречаемости маркеров острой инвазии в зависимости от длительности посттрансплантационного периода (см. рисунок).
У реципиентов ТФРП маркеры инвазированности и остроты токсоплазмоза выявляются значительно чаще, чем у реципиентов ОТТС. Так, показатель инвазированности составил 72,7%, маркеры острого токсоплазмоза выявлены у 27,3% обследованных. Таким образом, для всей обследованной популяции реципиентов солидных органов характерна достаточно высокая инвазированность возбудителем токсоплазмоза.
Согласно современным представлениям, токсоплазмоз после трансплантации органов может развиваться либо в результате реактивации латентно протекающего токсоплазмоза у реципиента на фоне обязательно проводимой иммуносупрессивной терапии, либо в результате пересадки серонегативному к T. gondii реципиенту зараженного токсоплазмами донорского органа. Реактивация токсоплазмоза может определяться особенностями препаратов и схем, используемых для иммуносупрессивной терапии [10–12]. Важным для ведения госпитального периода является выявление у реципиентов маркеров острой инвазии, при наличии которых, учитывая трудности интерпретации проявлений токсоплазмоза, следует с особой тщательностью оценивать клинический статус и варианты лекарственной поддержки. По имеющимся данным, после трансплантации наблюдаются разнообразные по проявлениям и тяжести клинические формы токсоплазмоза. Данные о встречаемости, локализации и проявлениях токсоплазмоза у реципиентов донорских органов представлены в табл. 2.
Представляется важным выделить особенности клинических проявлений токсоплазмоза. Во-первых, это клинические формы, связанные с развитием инвазии в связи с пересадкой зараженного цистами T. gondii донорского органа, в числе которых наиболее часто описаны миокардиты и перикардиты, наблюдаемые при пересадке сердца. Во-вторых, невозможно выделить какие-либо специфичные, типичные для токсоплазмоза клинические формы инфекции у реципиентов того или иного органа. Например, реактивация токсоплазмоза при трансплантации сердца может сопровождаться развитием энцефалита, миокардита, перикардита, хориоретинита и прочими, включая диссеминацию, формами инфекции токсоплазменной этиологии.
Среди реципиентов различных органов течение токсоплазменной инфекции часто заканчивается летальным исходом, у реципиентов сердца этот показатель достигает 50% [10], у реципиентов костного мозга – 66% [4], у реципиентов почки – 65% [5]. Наиболее неблагоприятный прогноз отмечается в период с 1-го по 4-й месяц после операции, что может быть связано с тяжестью иммуносупрессии. Согласно данным литературы [10, 11, 20], увеличение длительности послеоперационной иммуносупрессии может приводить к реактивации или развитию первичной токсоплазменной инфекции, смертность на фоне которой может достигать 50%. Развитие токсоплазмоза может способствовать отторжению пересаженного органа, что также может приводить к летальному исходу.
Сложность постановки клинического диагноза токсоплазмоза связана и с тем, что в ранние сроки после первичного заражения T. gondii специфические IgM и IgG еще не успевают образоваться; в таких случаях диагноз ставится посмертно [5]. Кроме атипичной клинической картины заболевания диагностика осложняется труднодоступностью возбудителя и соответственно невозможностью паразитологического или молекулярно-генетического выявления T. gondii. Наши собственные исследования свидетельствуют, что токсоплазмоз у реципиентов солидных органов, в частности сердца и печени, не имеет четко выраженной клинической симптоматики, и только лабораторное обследование может выявить серологические маркеры, подтверждающие развитие заболевания.
Поэтому анализ полученных данных дает нам основание рекомендовать для оптимизации диагностики токсоплазмоза у реципиентов солидных органов разработку обязательной схемы лабораторного мониторинга. Ранняя диагностика будет способствовать своевременному назначению соответствующей химиотерапии. В этой связи интересны данные литературы [10, 11], согласно которым реципиенты солидных органов и пациенты с аллогенной трансплантацией гемопоэтических стволовых клеток, получавшие препараты, эффективные против T. gondii (спирамицин, котримоксазол, клиндамицин, пириметамин), имели минимальный риск развития оппортунистического токсоплазмоза.
Анализ данных современной литературы и результаты собственных исследований свидетельствуют о важности проблемы трансплантационного токсоплазмоза для практического здравоохранения. Не вызывает сомнения необходимость более детальных клинических наблюдений, в частности, проведения обследования реципиентов и донорского материала на наличие специфических антител к T. gondii перед трансплантацией и в посттрансплантационном периоде. Подобного рода исследования необходимы прежде всего для выявления риска развития инвазии. При этом наличие токсоплазм в донорском органе свидетельствует о возможности развития токсоплазмоза после операции на фоне иммуносупрессии. В то же время у серонегативного реципиента существует риск развития приобретенного токсоплазмоза как следствие свежего заражения. Таким образом, осуществление динамического мониторинга, включающего комплексную оценку клинико-лабораторных, в частности, серологических показателей, в различные сроки после трансплантации предоставит материал для формирования научно обоснованных систем диагностики, лекарственной профилактики и лечения пациентов трансплантационного профиля.

Выводы
- Показатели инвазированности T. gondii (IgG) реципиентов солидных органов существенно превышают аналогичные показатели в популяции условно здоровых лиц.
- Клинически важным является достоверное увеличение числа реципиентов ОТТС и ТФРП с маркерами острой фазы токсоплазмоза (IgM и IgA).
- Выявлена отчетливая тенденция зависимости повышения уровней маркеров инвазированности и остроты токсоплазменной инфекции от длительности посттрансплантационного периода.


