В силу особого климатического и географического (низовья Волги) положения Астраханской области (АО) создаются очень благоприятные условия для существования природных очагов трансмиссивных инфекций, передающихся иксодовыми клещами. АО является в полном смысле эндемичной территорией для таких инфекций. Главная характеристика природных очагов – исключительная их стойкость [1, 2].
С каждым годом растет интенсивность хозяйственной деятельности, в связи с чем происходит изменение эпидемической ситуации: природные очаги активируются, расширяется ареал их распространения, и они превращаются в природно-хозяйственные (антропургические) очаги. Переносчиками и хранителями возбудителей являются иксодовые клещи – при Астраханской пятнистой лихорадке (АПЛ) – R. pumilio, при Крымской геморрагической лихорадке (КГЛ) – H. marginatum, численность которых тесно связана с уровнем заболеваемости населения [3, 4].
Если в природных очагах циркуляция возбудителя происходит между дикими животными и кровососущими насекомыми, то в антропургических очагах в процесс вовлекаются и домашние животные (собаки, коровы, козы, овцы), что приводит к росту заболеваемости среди людей [5, 6].
Большую актуальность для здравоохранения АО приобретают 2 трансмиссивных инфекции – АПЛ и КГЛ. Поскольку многое их объединяет – одинаковые механизм передачи, переносчики, сезонность, начало болезни – представляет интерес тщательное сравнение всех стадий клинического течения этих инфекций, что могло бы быть полезным для правильной своевременной диагностики, тем более что трудно поставить правильный диагноз из-за позднего обращения больных к врачу, а также частого лечения на дому. Даже при таком тяжелом заболевании, как КГЛ, в течение первых 3 сут. болезни были госпитализированы только 42% больных, на 4–5-й день – 36% и 22% больных были госпитализированы только на 6–8-й день болезни. Хуже обстоят дела при АПЛ: в 80% случаев первичное обращение к врачу отмечено только при появлении сыпи (5–6-й день болезни), и правильный диагноз первоначально был поставлен лишь 49% больных. В 23% случаев был поставлен диагноз «острая респираторная вирусная инфекция», в 24% – «лихорадка неясного генеза», в 4% – «вирусная инфекция неясной этиологии» [7, 8].
В связи с этим целью настоящего исследования было проведение сравнительной клинической характеристики двух трансмиссивных инфекций в АО – АПЛ и КГЛ.
Материалы и методы
В исследование были включены 3951 пациент с АПЛ и 151 пациент с КГЛ, обследованные в Областной инфекционной клинической больнице Астрахани.
Использованы данные за 2000–2016 гг. из первичных учетных документов форм федерального статистического наблюдения № 2 «Сведения об инфекционных и паразитарных заболеваниях», Ф.058/у «Экстренное извещение об инфекционном заболевании, пищевом, остром профессиональном отравлении, необычной реакции на прививку», Ф.№357/У «Карта эпидемиологического обследования очага инфекционного заболевания», Ф.№003/У «Медицинская карта стационарного больного», представленных Центром гигиены и эпидемиологии в Астраханской области.
Проведены сбор анамнеза, оценка состояния, осмотр и динамичное наблюдение за 165 больными АПЛ и 151 больным КГЛ.
У всех больных диагноз ставили на основании эпидемиологических данных, клинической картины и результатов лабораторного исследования. При АПЛ – по результатам серологических исследований парных сывороток в реакции непрямой иммунофлюоресценции (РНИФ) с видоспецифическим корпускулярным антигеном из астраханского штамма риккетсий. Сыворотку крови, взятую у больных, исследовали методом ПЦР в режиме реального времени с гибридизационно-флуоресцентной детекцией ДНК R. сonorii caspia с помощью набора «АмплиСенс R. сonorii caspia-FL», (Центральный НИИ эпидемиологии Роспотребнадзора, Москва). Молекулярно-генетические исследования больных АПЛ проводили на базе клинико-бактериологической лаборатории ОИКБ им. А.М. Ничоги Астрахани. Для выделения генома R. сonorii caspia использовали осадок нейтрофилов. При КГЛ для выявления РНК вируса Крымской-Конго геморрагической лихорадки (ККГЛ) методом ПЦР использовали тест-систему «АмплиСенс® ККГЛ» (Центральный НИИ эпидемиологии Роспотребнадзора, Москва). Вирусоспецифические антитела классов M (IgM) и G (IgG) определяли методом твердофазного ИФА с помощью тест-систем «ВектоВКЭ-IgM» и «ВектоВКЭ-IgG» (ЗАО «Вектор-Бест», Новосибирск).
Результаты и обсуждение
АПЛ – острое инфекционное, природно-очаговое заболевание, облигатно-трансмиссивная инфекция, возбудитель которого – R. conorii subsp. caspia – относится к генокомплексу R. conorii и передается человеку клещами Rhipicephalus pumilio. Необходимо отметить, что АПЛ является одним из доминирующих природно-очаговых заболеваний на территории АО [9].
КГЛ – зоонозное, природно-очаговое инфекционное заболевание, возбудитель которого – вирус ККГЛ семейства Bunyaviridae передается человеку клещами H. marginatum. Возбудитель КГЛ от клеща к человеку передается трансмиссивным, контактным и, возможно, аэрогенным путем (при тесном контакте с зараженными домашними животными).
Уровень заболеваемости КГЛ в АО в 10,7 раза выше, чем в среднем по Российской Федерации. Следует отметить низкий уровень заболеваемости КГЛ и значительно более высокий – АПЛ [2, 4, 9].
Чаще болеют взрослые люди трудоспособного возраста: КГЛ – лица в возрасте 30–50 лет (45%), АПЛ – лица в возрасте 50–70 лет (48%). Это связано с трудовой деятельностью населения: лица в возрасте 30–50 лет в большей степени заняты в животноводстве, лица 50–70 лет заняты работой на приусадебных участках. В АО 67% заболевших АПЛ за анализируемый период – сельские жители (2647 чел.), городские жители составляют 33% (1304 чел.). Большинство больных КГЛ и АПЛ составляют мужчины – 62 и 74% соответственно. Анализ структуры заболевших КГЛ и АПЛ по социальному и профессиональным признакам показал, что болеют ими все группы населения, однако в большей мере – работники сельскохозяйственных предприятий и ферм (27 и 45% соответственно), пенсионеры (21 и 18%), безработные (18 и 16%). Сезонность при АПЛ имеет весенне-летне-осенний характер (май–сентябрь), при КГЛ – весенне-летний (апрель–август). Инкубационный период при АПЛ 7–10 дней (до 30 дней), при КГЛ – 3–7 дней (до 14 дней) [10–16].
Основное различие между АПЛ и КГЛ – в степени тяжести болезни. Так, при АПЛ до 2013 г. не встречались тяжелые случаи заболевания. При КГЛ не было отмечено легкого течения заболевания.
Начало болезни – острое при обеих инфекциях. В начале болезни при АПЛ отмечаются слабость, головная боль, мышечные и суставные боли, повышение температуры до 37–38 °С, у 15% – до 39 °С. Начальный период продолжается 3 дня, лихорадочный – 8 дней. Одним из постоянных симптомов АПЛ была температурная реакция. Повышение температуры до субфебрильных, а чаще фебрильных значений наступало уже в 1-й день болезни. Большое значение для диагностики заболевания в начальном периоде имеет обнаружение специфического поражения кожи на месте присасывания клеща – первичного аффекта, который представляет собой инфильтрат, возвышающийся над уровнем кожи, плотный, размерами 0,2×0,5 см, окруженный гиперемированным ореолом с некрозом в центре. Локализации первичного аффекта были самыми разнообразными – лицо (3%), грудь и живот (8%), бедра (12%), голени (67%), ягодичная или паховая область (4%), волосистая часть головы (6%). Обнаруженный первичный аффект сохранялся на протяжении всей болезни. В 68% случаев у пациентов отмечали увеличение лимфатических узлов. Они при пальпации плотные, подвижные, безболезненные, в диаметре до 2 см, не спаянные с окружающими тканями.
Начиная с первых дней болезни у пациентов наблюдались конъюнктивит и склерит (59%), длительность которых составляла 7 дней.
При КГЛ начало болезни острое – подъем температуры до 39,0–40,0 °С, в течение первых 3 суток – выраженный потрясающий озноб. Основной тип лихорадочной реакции представлен в виде «ремитирующей» кривой (69%), а у 31% больных – «двугорбой» температурной кривой. На 3–5-е сутки болезни температура кратковременно снижается до нормальных значений, что обозначается как «врез температурной кривой», а затем вновь повышается. «Врез температуры» у больных КГЛ совпадает с появлением геморрагических элементов на кожных покровах.
Разгар болезни при АПЛ и КГЛ различен, что связано с наличием или отсутствием геморрагического синдрома (ГС), который при АПЛ отмечают крайне редко, тогда как при КГЛ он возникает у 90% больных, особенно при тяжелом течении. Чтобы подчеркнуть различия между проявлениями АПЛ и КГЛ, мы проанализировали состояние 165 больных со среднетяжелым течением АПЛ и 151 больного со среднетяжелым и тяжелым течением КГЛ.
При АПЛ в разгар болезни у 85% больных отмечена температура в пределах 37,5–39,0 ºС, у 15% больных она поднималась до 39,0–39,5 ºС. Средняя длительность лихорадочного периода составляла 8–9 дней. В этот период пациенты жаловались на головную боль (100%), чаще упорную, диффузного характера, и слабость (100%). Выраженные боли в мышцах и суставах отмечали 94% пациентов. Расстройства сна отмечали 42% заболевших, снижение аппетита – 100%; тошноту – 18%. На однократную и повторную рвоту жаловались 6% обследованных. Гиперемия лица и склероконъюнктивит проявились у 5%. У большинства больных обнаружены такие важные для диагностики признаки болезни, как сыпь (100%) и первичный аффект (35%), который нередко сочетался с регионарным лимфаденитом.
На фоне интоксикации у больных АПЛ появлялся дополнительный признак – экзантема, которая возникала в результате прорыва возбудителя через лимфатический барьер в кровяное русло (риккетсемия). сыпи В 1–2-й день болезни сыпь появилась у 11%, к 4–5-му дню – у 84%, после 6–7-го дня – у 6% больных. Обильное высыпание отмечено у 61%, необильное – у 39% больных. Особенно интенсивной сыпь была на конечностях. Чаще всего она имела розеолезно-папулезный характер, установлена у 100% больных.
Со стороны сердечно-сосудистой системы в разгар болезни в 91% случаев были выявлены расширение границ сердца и приглушение тонов. У 80% больных наблюдалась относительная брадикардия, у 20% – тахикардия. У части из них вслед за тахикардией развивалась брадикардия.
В легких в 18% случаев выявляли сухие хрипы и кашель, причем эти явления наблюдали кратковременно на 1-й неделе болезни.
В зеве у 86% больных была умеренная гиперемия с единичными геморрагиями на мягком небе. Отмечены увеличение печени (88%) и селезенки (3%). Функции печени не нарушены. Гепатоспленомегалия сохранялась в среднем 10–12 дней (рис. 1).
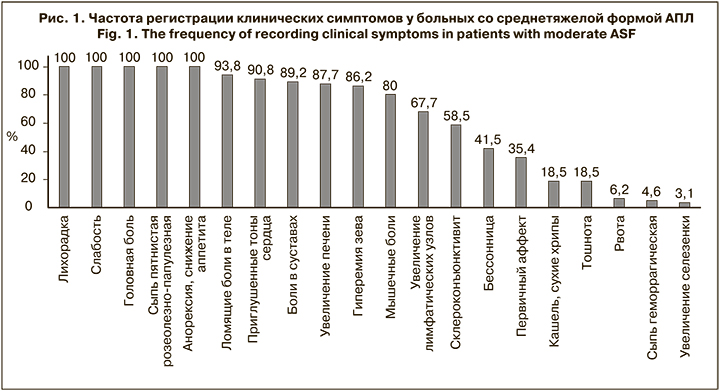
Изменения со стороны нервной системы проявлялись прежде всего головной болью (100%) и расстройством сна (42%). У 10 (6%) больных АПЛ возникло осложнение – инфекционно-токсический шок I–II степени.
В периоде реконвалесценции самочувствие больных постепенно улучшалось, нормализовалась температура тела, появлялся аппетит, исчезали симптомы интоксикации. К 4–5-му дню отпадала корочка первичного аффекта с образованием поверхностной язвочки, которая эпителизировалась, оставляя после себя сильно пигментированное пятно с шелушением кожи. Исчезал лимфаденит. С нормализацией температуры самочувствие больных быстро улучшалось, восстанавливалась активность, и после выписки из стационара они возвращались к трудовой деятельности.
Всем больным проведены общие анализы крови и мочи, у 29% определяли печеночные пробы. Выявлены умеренный лейкоцитоз (8,5–11,0 × 109/л) – у 10%, лейкопения – у 9%, сдвиг формулы влево – у 39%, в 32% случаев повышены СОЭ (22–45 мин/ ч), в 12% – активность АЛТ (1,38–3,03 ммоль/л). В моче у 3 (1,8%) пациентов отмечены изменения: белок 0,165 г/л, цилиндры – 2 ед. в поле зрения.
В наших исследованиях летальных исходов не было.
Из 151 случая КГЛ у 106 (70%) пациентов была среднетяжелая форма. У 52% больных выявлено наличие первичного аффекта, который преимущественно локализовался на нижних конечностях и туловище. Первичный аффект представлял собой пятно или папулу с четкими контурами до 0,4–0,8 мм в диаметре ярко-красного цвета с геморрагическим содержимым (94%). В центре его была обнаружена геморрагическая корочка с узкой каймой эпителия по периферии. На 8–9-й день первичный аффект бесследно исчезал или разрешался точечной поверхностной атрофией на месте геморрагической корочки.
У больных с КГЛ средней тяжести в 95% случаев заболевание начиналось остро – с внезапного подъема температуры тела до 39,0–40,0 °С, а у 7% заболевших отмечался субфебрилитет в течение первых 2 суток. В дальнейшем температура тела повышалась. В течение первых 3 суток лихорадка сопровождалась ознобом. Основной тип лихорадочной реакции представлен в виде «ремитирующей» кривой (70%), а у 32% больных – «двугорбой» температурной кривой.
В 45% случаев лихорадка завершалась укороченным лизисом. У 26% больных в вечерние часы отмечали субфебрилитет 37,1–37,6 °С в течение 2–3 дней. Критическое снижение температуры отмечено в 29% случаев. Общая длительность лихорадочного периода в среднем составляла 6–7 дней.
Основные клинические симптомы при среднетяжелом течении КГЛ представлены на рис. 2.
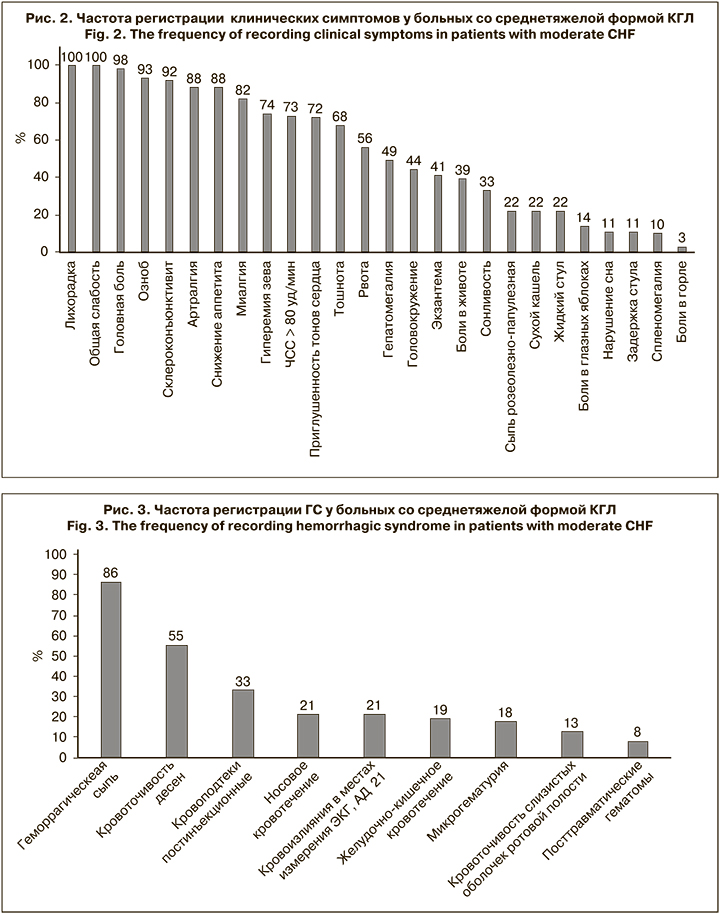
Симптоматика дисфункции ЦНС и ее вегетативных отделов у пациентов была невыраженной и проявлялась только при тяжелом течении болезни с развитием ГС. Пациенты, как правило, были заторможены (82%) при разговоре отмечали замедленность речи, быстрое истощение. 14% больных жаловались на боли в глазных яблоках, усиливающиеся при их движении. Головокружение отмечали у 44% пациентов, оно сопровождалось многократной рвотой, не приносящей облегчения. Ярко выраженные признаки энцефалопатии обнаружены только у больных с ГС при тяжелом течении болезни.
Главным и грозным проявлением тяжелых форм КГЛ является наличие геморрагических проявлений в виде полостных и бесполостных кровотечений. В 1–2-й день болезни регистрировали одно из ранних проявлений ГС – эритему кожных покровов лица, шеи и верхних отделов груди, сопровождающуюся чувством жара и гиперестезией на фоне лихорадки. В дальнейшем у 89% пациентов с клиническими проявлениями ГС, в среднем на 4–5-й день болезни, регистрировали геморрагическую сыпь в виде отдельных петехий или групповых скоплений, образующих специфические полосы.
Розеолезно-папулезная сыпь была зафиксирована на 6–7-е сутки у 35% больных без клинических симптомов нарушений в системе гемостаза и у 12% – с клинической картиной ГС.
В единичных случаях кожные высыпания имели смешанный характер и вид розеолезно-папулезной сыпи с геморрагическим компонентом (13%). Экзантема сохранялась в среднем до 5 дней, при этом у 21% пациентов отмечали пигментацию элементов.
Бесполостные кровотечения были представлены посттравматическими (8%), постинъекционными кровоподтеками (34%), кровоточивостью десен (55%) (рис. 3).
Постинъекционные кровоподтеки и кровоизлияния в области подключичного катетера диаметром 1–4 см регистрировали с 5–6-го дня, они продолжались до 11-го дня болезни. У всех больных манжеточная проба Румпеля–Лееде–Кончаловского была положительной (от 15 до 20 петехий). Кроме того, наблюдались кровоизлияния в местах присоединения присосок при проведении ЭКГ.
56% пациентов отмечали кровоточивость десен. Визуально слизистые десен, языка, небных дужек и внутренней поверхности щек выглядели рыхлыми и сочными.
Из проявлений полостных кровотечений у 21% больных выявляли носовые, которые носили кратковременный характер. Также в 18% случаев фиксировали микрогематурию в виде обнаружения в осадке мочи до 4 эритроцитов в поле зрения. У 19% пациентов возникали эпизодические кровотечения из отделов желудочно-кишечного тракта в виде рвоты «кофейной гущей» или наличия кала темного цвета с лабораторным подтверждением на скрытую кровь.
По мнению ряда исследователей, поражение органов дыхания у больных КГЛ является редким проявлением болезни со скудной симптоматикой и расценивается как осложнение заболевания. В 25% эпизодов пациенты предъявляли жалобы на сухой редкий кашель. У 36% наблюдаемых была отмечена нестабильность аускультативных данных в среднем до 9-го дня болезни: в течение суток прослеживали волнообразную динамику смены сухих и влажных хрипов [12, 13].
Нарушения со стороны деятельности сердечно-сосудистой системы выявляли в 85% случаев. Приглушенность сердечных тонов регистрировали у 73% пациентов. Частота сердечных сокращений не являлась информативным показателем, так как в основном оставалась в пределах общепринятых средних значений. Систолическое АД колебалось в пределах от 100 до 130 мм рт. ст., а диастолическое – не изменялось.
Основными жалобами, свидетельствующими о вовлечении в инфекционный процесс КГЛ пищеварительной системы, являлись анорексия, тошнота, рвота. Их регистрировали на 1–2-й день болезни у 88% пациентов, но продолжительность их различалась в зависимости от развития ГС.
Тошнота постоянно присутствовала у 69% больных до 4-го дня болезни, при этом у 56% она сопровождалась рвотой. Снижение аппетита, нередко до анорексии, в основном регистрировали у больных с ГС. Боли в животе регистрировали в 39% случаев. Они носили диффузный характер с мигрирующим компонентом и дольше сохранялись у больных с ГС.
Увеличение печени в основном регистрировали у больных с клиническими признаками ГС. Гепатомегалию выявляли на 6–7-й день болезни, что по срокам совпадало с появлением симптомов ГС. Повышение биохимических показателей крови регистрировали у 42% больных, концентрация общего билирубина повышалась до 22,5 мкмоль/л. В основном отмечали увеличение непрямого билирубина, что свидетельствовало о механизмах нарушения на уровне гепатоцитов. Активность АЛТ – до 60 Eд/л. Увеличение селезенки регистрировали в 10% случаев. Данные показатели снижались до нормальных значений в среднем на 10-й день и совпадали с периодом ранней реконвалесценции.
Со стороны мочевыделительной системы яркой клинической симптоматики не наблюдали. 16% пациентов отмечали боли в поясничной области, но они носили разлитой характер и были преимущественно связаны с миалгией. Снижение диуреза обнаруживали у пациентов в момент повышения температуры тела. Протеинурию (до 0,43 г/л) регистрировали только у пациентов с ГС, что свидетельствовало о нарушении проницаемости клубочкового фильтра. Выявленные изменения со стороны выделительной функции почек были непродолжительными и к периоду реконвалесценции у всех больных регрессировали.
За период с 2000 по 2016 г. тяжелое течение КГЛ отмечено у 45 (30%) пациентов. Их средний возраст – 56 лет, 88% составляли мужчины. У этих больных ГС регистрировали в 94% случаев.
При тяжелом течении КГЛ заболевание начиналось остро, с внезапного подъема температуры тела до 39,0–40,0 °С. Больные самостоятельно принимали жаропонижающие средства в течение 4–5 дней с момента начала болезни, чем и была обусловлена поздняя госпитализация в стационар. Длительность лихорадки составляла в среднем 18 дней, при этом в 66% наблюдений выявляли «двугорбую» температурную кривую с врезом на 4–5-й день болезни.
Летальный исход был у 8 (17,7%) из 45 больных с тяжелой формой КГЛ – у 6 (75%) мужчин и 2 (25%) женщин. Средний возраст составил 43–44 года. Из 8 больных с летальным исходом 3 (37,5%) были госпитализированы в первые 2 дня болезни, 4 (50%) – на 4–6-й день и 1 (12,5%) – на 9-й день. У всех в анамнезе отмечено острое начало болезни с потрясающего озноба и быстрого нарастания температуры тела до высоких значений. У этих больных были интенсивная головная боль, головокружение, выраженная слабость, анорексия, тошнота, многократная рвота и жидкий стул до 8 раз в сутки. Больные жаловались на боли в животе и поясничной области, головокружение. У 3 (37,5%) больных были обморочные состояния. У 2 (25%) больных вначале болезни была брадикардия (58–60 сердечных сокращений в минуту), но в дальнейшем нарастали тахикардия, гипотония. У 4 (50%) больных развился геморрагический шок, у 3 (37,5%) – инфекционно-токсический шок II–III степени. На 2–3-й день болезни у 7 (87,5%) больных появилась геморрагическая сыпь, у 5 (62,5%) – сыпь была обильной, у 1 (12,5%) – множественной. В местах инъекций у всех больных, в области подключичного катетера отмечались массивные кровоподтеки, и на 3–4-й день болезни появлялись кровоточивость десен, носовые и массивные желудочно-кишечные кровотечения, приводящие к выраженной анемии (количество эритроцитов в крови снижалось до 1,7 × 1012/л.). У 6 больных отмечены признаки токсической энцефалопатии: нарушение сознания, явления менингизма; у 5 развилась острая почечная недостаточность. В периферической крови у 6 пациентов отмечена выраженная лейкопения (минимальное количество лейкоцитов составило 1,8×109/л). У 1 больного КГЛ, осложнившейся двусторонней пневмонией, отмечен лейкоцитоз.
При анализе заболеваемости КГЛ за период 2000–2016 гг. легких форм не выявлено. Преобладали среднетяжелые формы болезни (70% случаев), при которых отмечались необильные носовые кровотечения. Тяжелые формы болезни (30% случаев) сопровождались обильными полостными кровотечениями и другими осложнениями. За период с 2000 по 2016 гг. зарегистрировано 8 летальных исходов КГЛ.
Заключение
Проведенный сравнительный клинический анализ течения двух трансмиссивных инфекций – АПЛ и КГЛ – в Астраханской области показал, что эти инфекции имеют общие характеристики: трансмиссивный путь передачи; заражение людей, пребывающих в загородных зонах и имеющих контакт с клещами; весенне-летнюю сезонность, начало болезни. Однако существуют серьезные различия, связанные с тем, что вирус КГЛ более контагиозен и заболевание протекает намного тяжелее, чем АПЛ, и сопровождается обильными полостными кровотечениями и осложнениями, вовлекающими все органы и системы пациента. За анализируемый период отмечено 8 случаев КГЛ с летальным исходом.
При АПЛ заболевание начиналось остро во всех случаях, сопровождалось лихорадкой, слабостью и головной болью, полиморфной сыпью, наличием первичного аффекта (35%), артралгиями (89%) и миалгиями (80%). Болезнь протекала в среднетяжелой форме и заканчивалась выздоровлением. В наших исследованиях летальных исходов не было.
Учитывая, что КГЛ является особо опасной инфекцией, для врачей всех специальностей главными задачами являются своевременная диагностика и профилактика тяжелых форм КГЛ, а также предотвращение летальных исходов. Данное исследование поможет врачам правильно и своевременно дифференцировать диагноз между этими двумя клещевыми инфекциями.


