Корь (К) – высоко контагиозное инфекционное заболевание, которое вызывает РНК-содержащий вирус рода Morbillivirus, семейства Paramyxoviridae. Известно о существовании 8 групп вируса К, обозначаемых от А до Н, включающих 24 генотипа. Группы A, E, и F представлены единичным генотипом, в то время как группы B, C, D, G, и H включают от 2 до 11 генотипов.
Тяжелое течение К, формирование неблагоприятных исходов заболевания связаны с развитием осложнений. Заболевание может протекать тяжело в любом возрасте. К группам риска по развитию тяжелого течения К и возникновению осложнений относят детей младше 5 лет, взрослых старше 20 лет, беременных, пациентов с иммунодефицитными состояниями (ВИЧ-инфекция, лейкоз) [1, 2].
Вакцинации против К живой аттенуированной вакциной, начатая в мире в 60-х годах прошлого века, привела к существенному снижению заболеваемости, что позволило поставить цель элиминации К во всех 6 регионах ВОЗ. Несмотря на ранее достигнутые успехи, в последние годы ситуация по К во многих регионах ухудшилась. Так, в Европейском регионе в 2018 г. было зарегистрировано более 80 000 случаев заболевания (в сравнении с 6 000 в 2016 г.) [3]. В 2019 г. продолжился рост заболеваемости этой инфекцией в регионе. Количество зарегистрированных случаев К возросло до 104 248 [4, 5].
В Республике Беларусь в последние 2 десятилетия заболеваемость К низкая: в основном – менее 1 случая на 1 млн населения [6]. По данным Европейской региональной комиссии по верификации элиминации К и краснухи, Республика Беларусь отнесена к группе стран, где обе эти инфекции элиминированы [7]. В последние годы участились эпизоды завоза вируса К, которые в ряде случаев получили распространение на территории страны. Так, в 2018 г. было выявлено не менее 40 таких эпизодов, зарегистрировано 259 случаев заболевания [8]. В 2019 г. количество завозов выросло до 58, зарегистрирован 201 случай К. Как показал анализ вакцинального статуса заболевших в последние годы, 46,7% из них были привиты с использованием 1 или 2 доз вакцины. И хотя заболеваемость среди непривитых лиц многократно превышала показатели заболеваемости среди привитых, вовлечение в эпидемический процесс К привитых подчеркивает актуальность проблемы на современном этапе, а также необходимость дальнейшего изучения клинико-эпидемиологических особенностей этого заболевания в условиях многолетней вакцинации.
Цель исследования – определение клинико-эпидемиологических и диагностических особенностей К во время вспышки в Гродненской области Республики Беларусь в 2019 г.
Материалы и методы
Выполнен ретроспективный анализ историй болезни 43 пациентов с диагнозом «корь», находившихся на лечении в УЗ «Гродненская областная инфекционная клиническая больница» (далее – ГОИКБ) в 2019 г., когда с 12 апреля по 18 июня был зарегистрирован резкий подъем заболеваемости К. У всех пациентов клиническая картина соответствовала стандартному определению случая К и диагноз был подтвержден лабораторно выявлением IgM-антител к вирусу К либо обнаружением РНК вируса в моче и/или мазке из носоглотки.
Лабораторную диагностику К выполняли в ГО «Республиканский научно-практический центр эпидемиологии и микробиологии» (Минск).
В соответствии с рекомендациями ВОЗ основным методом диагностики было выявление IgM-антител к вирусу К методом ИФА [9]. В отдельных случаях (при сомнительном результате исследования IgM-антител либо при наличии клинической картины инфекции и отрицательных результатах выявления IgM-антител у ранее вакцинированных пациентов) выявляли РНК вируса в клиническом материале (мазок из носоглотки, моча) с использованием диагностической ОТ-ПЦР. Для установления происхождения вируса и расшифровки цепочек его передачи выполняли секвенирование фрагмента вирусного генома с последующим генотипированием.
Антитела класса IgM к вирусу К определяли с использованием иммуноферментных тест-систем производства фирмы Euroimmun (Германия) и АО «Вектор-Бест» (Россия). На наличие IgM-антител были обследованы все 43 пациента.
Выделение вирусной РНК из клинического материала выполняли с помощью набора «АртРНК MiniSpin» (ООО «АртБиоТех», Республика Беларусь).
РНК вируса определяли методом диагностической одностадийной ОТ-ПЦР в режиме реального времени и/или в одностадийной ОТ-ПЦР с электрофоретической детекцией продуктов реакции. В одностадийной ОТ-ПЦР в режиме реального времени с набором реагентов «ArtMix-RT ревертаза» (ООО «АртБиоТех», Республика Беларусь) и праймерами, разработанными K.B. Hummel и соавт. [8], исследованы образцы мочи и мазки из носоглотки 7 пациентов.
С помощью одностадийной ОТ-ПЦР с праймерами MeV214/MeV216 с электрофоретической детекцией продуктов реакции исследован клинический материал от 22 пациентов (20 образцов мочи, 19 мазков из носоглотки). У 11 пациентов с целью генотипирования вируса К выполнено секвенирование амплифицированного фрагмента генома (450 нуклеотидов С-терминальной области N-гена) [10].
Фрагменты кДНК вируса К вырезали из геля, очищали с использованием набора QIAEX II Gel Extraction Kit (QIAGEN, Германия) и секвенировали в обоих направлениях с использованием набора BigDye Terminator v.3.1 Cycle Sequencing Kit на капиллярном секвенаторе модели 3500 (Applied Biosystems, США).
Редактирование полученных нуклеотидных последовательностей осуществляли с использованием лицензионного программного обеспечения SeqScape v.3.0 (Applied Biosystems, США). Филогенетический анализ выполняли с помощью программы MEGA версии 6 [11]. Эволюционные расстояния между последовательностями определяли на основании двухпараметрической модели эволюции Кимура. Достоверность топологий филограмм оценивали методом псевдореплик (анализировали 1000 псевдореплик).
Статистическую обработку результатов проводили с использованием программы Statistica, версия 10. Нормальность распределения величин оценивали с помощью W-критерия Шапиро–Вилка. Для сравнения групп данных использовали непараметрические методы. Для сравнения двух независимых выборок использовали U-критерий Манна–Уитни, критерий χ2. Данные представлены в виде медианы (Ме) с указанием минимальных и максимальных значений показателей (min–max). В качестве критерия достоверности различий показателей принимали уровень значимости p < 0,05.
Результаты
С 12 апреля по 18 июня 2019 г. в ГОИКБ было госпитализировано 43 пациента с диагнозом «корь». Возраст взрослых варьировал от 18 до 46 лет (в среднем 23,5 года), детей – от 6 мес. до 16 лет (в среднем 6 лет).
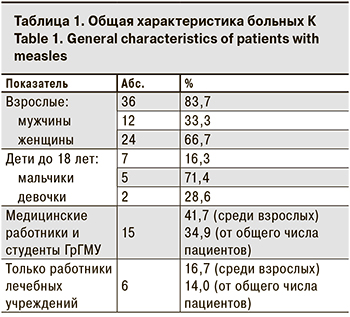 Среди заболевших было 36 взрослых, их доля составила 83,7% (p < 0,0001). При этом женщин было в 2 раза больше, чем мужчин – 24 (66,7%) и 12 (33,3%) соответственно (p < 0,05). Среди детей заболели 5 мальчиков и 2 девочки.
Среди заболевших было 36 взрослых, их доля составила 83,7% (p < 0,0001). При этом женщин было в 2 раза больше, чем мужчин – 24 (66,7%) и 12 (33,3%) соответственно (p < 0,05). Среди детей заболели 5 мальчиков и 2 девочки.
Данные пациентов, заболевших К, представлены в табл. 1.
Значительную долю пациентов составили работники лечебных учреждений и студенты медицинского университета (41,7%), что связано с более высоким риском передачи инфекционных заболеваний в этой группе. Прививочный статус заболевших К в зависимости от возраста представлен на рисунке. Среди 38 заболевших в возрасте старше 10 лет 28 (73,7%) получили 2 дозы вакцины против К.
По данным Г.А. Харченко и соавт. [12], К наиболее распространена среди детей раннего возраста. Так, из 340 случаев заболевания у детей пациенты в возрасте 2–3 лет, которые не были привиты против К, составили 31,5%, а дети в возрасте до 1 года, не подлежащие вакцинации по возрасту, – 44,6%.
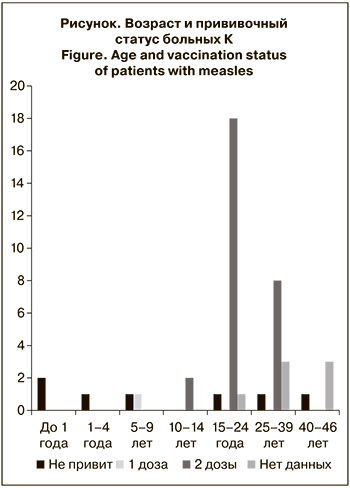 Анализ сроков возникновения заболевания после получения последней дозы противокоревой вакцины показал, что 86,2% пациентов, вакцинированных против К, заболели через 10 и более лет после ревакцинации, что косвенно указывает на снижение поствакцинального иммунитета со временем. На снижение концентрации поствакцинальных антител вплоть до полной их утраты у определенной доли лиц мы указывали в предыдущей своей работе [13], это отмечали и другие исследователи [14, 15].
Анализ сроков возникновения заболевания после получения последней дозы противокоревой вакцины показал, что 86,2% пациентов, вакцинированных против К, заболели через 10 и более лет после ревакцинации, что косвенно указывает на снижение поствакцинального иммунитета со временем. На снижение концентрации поствакцинальных антител вплоть до полной их утраты у определенной доли лиц мы указывали в предыдущей своей работе [13], это отмечали и другие исследователи [14, 15].
При анализируемой вспышке К, где среди заболевших преобладали взрослые пациенты, доля вакцинированных более чем в 2 раза превышала долю лиц, невакцинированных или имеющих неустановленный вакцинальный статус (p < 0,001).
31 (72,1%) госпитализированный пациент был направлен в стационар участковыми врачами или бригадой скорой медицинской помощи с диагнозом «корь или корь?». В то же время 12 (27,9%) пациентов были направлены в инфекционную больницу с другими диагнозами: «острая респираторная инфекция», «аллергический дерматит», «энтеровирусная инфекция» и др. При направлении на госпитализацию указание на контакт с пациентом, у которого подозревали или уже диагностировали К, было у 18 (41,9%) заболевших. На уровне приемного отделения при поступлении предварительный диагноз К был выставлен 39 (90,7%) пациентам, 6 больным кроме К выставляли альтернативные диагнозы: «острая респираторная инфекция», «аллергический дерматит», «инфекционная экзантема».
У 42 из 43 пациентов при поступлении были сыпь, повышенная температура тела, что и послужило основанием для направления на госпитализацию в инфекционную больницу.
Продолжительность продромального периода К устанавливали на основании данных анамнеза и анализа медицинской документации пациентов. У 6 (13,95%) пациентов он отсутствовал, так как начало заболевания манифестировало с одновременного подъема температуры тела и появления высыпаний. Продром продолжительностью 1 день установлен у 9 (20,9%) пациентов, 2 дня – у 11 (25,6%), 3 дня – у 12 (27,9%), 4 дня и более – у 5 (11,6%). Таким образом, у 26 (60,5%) пациентов, среди которых было 5 детей и 21 взрослый, установлено отсутствие или сокращение продолжительности продромального периода К до 1–2 дней. При этом 19 (73,1%) из 26 пациентов были вакцинированы против К, у 7 (26,9%) вакцинация или данные о ней отсутствовали (p > 0,05).
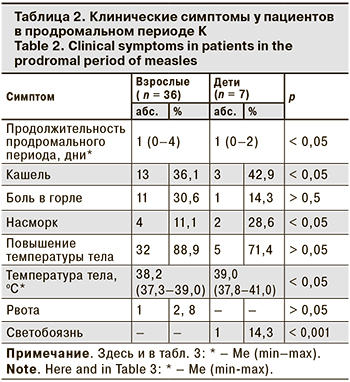 Как видно из табл. 2, продромальный период у взрослых продолжался дольше, чем у детей. Температура тела у них также была выше.
Как видно из табл. 2, продромальный период у взрослых продолжался дольше, чем у детей. Температура тела у них также была выше.
Пятна Бельского–Филатова–Коплика (ПБФК) были отмечены у 11 взрослых и 4 детей (p > 0,05). У всех пациентов они присутствовали одновременно с сыпью, у некоторых были значительно выражены, распространялись на десны. Как правило, пятна исчезали в течение 2–3 дней. Также у всех пациентов на мягком и твердом небе отмечена энантема разной степени выраженности.
Сыпь у больных имела макуло-папулезный характер. Характерная для классической картины К стадийность сыпи была отмечена у 16 взрослых и 6 детей (p > 0,05). Стадийность сыпи имела место у 13 из 29 вакцинированных пациентов, у 6 из 7 невакцинированных и у 3 с неизвестным вакцинальным статусом (p > 0,05). Одномоментное высыпание было у 4 (11,1%) взрослых. У 16 (37,2%) пациентов сыпь на нижних конечностях отсутствовала, в течение 1 сут. она наблюдалась у 4 (9,3%) больных, 2 сут. – у 17 (16,3%), 3 сут. – у 15 (34,9%), 4 сут. – у 7 (16,3%).
Характерные симптомы болезни в период разгара К у взрослых и детей представлены в табл. 3. В период высыпаний у детей был более выражен катаральный синдром, у них чаще отмечали кашель и конъюктивит. В большинстве случаев К протекала в среднетяжелой форме, у 7 взрослых – в легкой форме. Тяжелая форма заболевания отмечена у 1 непривитого взрослого пациента.

К осложнениям К были отнесены по 1 случаю бронхита у детей и взрослых (p > 0,05).
При сравнении гемограмм установлены достоверные различия показателей крови у взрослых и детей при выписке из стационара. Содержание сегментоядерных нейтрофилов было выше у взрослых – в 23,0 (13,0–63,0) и 50,0% (12,0–62,0) случаев соответственно (p < 0,05), а лимфоцитов – у детей: в 70,0 (30,0–85,0) и 42,0% (26,0–80,0) случаев (p < 0,05). Кроме того, лейкоцитарный индекс интоксикации при выписке из стационара был выше у взрослых – 0,6 (0,02–2,3) против 0,1 (0,05–1,1) соответственно (p < 0,01) .
Одним из аспектов исследования был сравнительный анализ клинических данных привитых (n = 29) и непривитых (n = 7) пациентов без учета лиц с отсутствием данных о вакцинации. У непривитых в продроме отмечена более высокая температура тела – 38,8 оС (38,0–39,0) против 38,0 оС (37,2–41,0) соответственно; большая продолжительность лихорадки в целом – 5,1 (4,0–9,0) и 3,9 (1,0–9,0) дней (p < 0,05). Подобные закономерности отмечали и другие авторы: у непривитых лиц К имеет более тяжелое течение, нередко с осложнениями [16].
Представлял интерес также анализ результатов лабораторной диагностики заболевания. Серологическое обследование было проведено 43 пациентам, из них IgM-антитела к вирусу К были выявлены у 36 (83,7%), у 2 (4,7%) пациентов их наличие было сомнительным (серая зона), у 5 (11,6%) – IgM-антитела не обнаружены. При исследовании методом ОТ-ПЦР в реальном времени у этих 7 пациентов выявлена РНК вируса К в моче, в мазке из носоглотки ни у одного из них вирусная РНК обнаружена не была.
Согласно рекомендациям ВОЗ, оптимальные сроки серологического обследования на наличие IgM-антител к вирусу К – с 4-го по 28-й день от появления сыпи [9]. В нашем исследовании только у 1 из 7 пациентов с отсутствием или сомнительным уровнем IgM-антител забор крови был выполнен слишком рано (на следующий день после появления сыпи), что могло привести к ложноотрицательному результату. У 6 пациентов забор крови был выполнен своевременно, на 4–5-й день после появления сыпи. 6 пациентов были привиты двукратно, у 1 данные о вакцинации отсутствовали, что, вероятно, и явилось причиной отсутствия специфических IgM-антител.
Обсуждение
Схожие результаты получены и другими исследователями. При проведении эпидемиологического надзора за корью в Китае за 4-летний период (2014–2017 гг.) у 18,7% заболевших, ранее привитых от К, IgM-антитела не выявлялись, диагноз был постановлен на основании обнаружения РНК вируса К методом ОТ-ПЦР [6]. Как показывают опыт и данные литературы [6, 7], в странах с высоким уровнем охвата прививками, когда случаи К регистрируют у ранее вакцинированных, применение ОТ-ПЦР наряду с серологическими исследованиями для диагностики заболевания является необходимым [6, 7]. Кроме того, важную информацию по диагностике К у привитых может предоставить исследование авидности IgG [17].
Согласно руководству ВОЗ, мазок из носоглотки и мочу для исследования в ОТ-ПЦР рекомендовано собирать в течение 7 дней после появления сыпи, поскольку в дальнейшем содержание вирусной РНК заметно снижается [9]. Однако в нашем исследовании ни в одном из мазков, забранных в оптимальные сроки (на 2–6-й день после появления сыпи), РНК вируса К обнаружена не была, тогда как она присутствовала в моче у всех 7 пациентов. Отсутствие (или присутствие в течение очень короткого периода) РНК вируса К в носоглотке у ранее привитых заболевших указывает на то, что вероятность инфицирования ими контактных лиц значительно ниже, чем непривитыми заболевшими.
Как известно, при исследовании в ОТ-ПЦР в реальном времени сравнение значений порогового цикла (Ct) амплификации позволяет сравнить относительное содержание РНК вируса в образцах. Для пациента без данных о прививках значение Ct для образцов мочи составило 31,77 (материал был забран на 5-й день), тогда как для привитых пациентов оно оказалось значительно выше – 37,37–40,00 (в среднем 38,52; предел чувствительности реакции – 40). В работе, посвященной разработке диагностической ОТ-ПЦР, авторы приводят результаты исследования 37 образцов мочи и мазков из носоглотки от непривитых больных К: значения Ct варьировали от 16,47 до 36,23 (в среднем 25,74) [2]. Полученные результаты указывают на то, что у привитых лиц содержание вирусной РНК в биологическом материале значительно ниже в сравнении с непривитыми.
Наряду с применением ОТ-ПЦР в реальном времени в диагностических целях ОТ-ПЦР с электрофоретической детекцией продуктов реакции выполняли с целью последующего секвенирования фрагмента генома. При исследовании 20 образцов мочи и 19 мазков из носоглотки, собранных в течение 7 дней после появления сыпи у 22 заболевших, вирусная РНК была выявлена в 17 (85%) образцах мочи и 5 (26%) мазках. Результаты обнаружения РНК вируса К с использованием двух модификаций ОТ-ПЦР показали, что у ранее привитых лиц моча оказалась более предпочтительным биологическим материалом для исследования, чем мазок из носоглотки.
В ходе эпидемиологического расследования в г. Гродно установлено, что 65,7% заболевших сформировали 18 очагов без последующей передачи кори, в то же время имели место 5 очагов с последующей передачей К в очаге. Доля пациентов, поступивших из этих очагов, составила 34,3%.
Секвенирование и последующее генотопирование вирусов К от 11 пациентов показало, что они относились к 2 генотипам – B3 (выявлен у 3 пациентов) и D8, геновариант Gir Somnath (выявлен у 8 пациентов), что позволяет говорить о наложившихся по времени друг на друга 2 вспышках кори. Установлено, что вирус генотипа B3 был завезен на территорию г. Гродно из Азербайджана в конце апреля 2019 г. и получил незначительное распространение, обусловив цепочку передачи, включавшую 7 заболевших. Циркуляция вируса продолжалась в течение 1 мес., до конца мая 2019 г. Первый установленный случай заболевания, вызванный вирусом D8, Gir Somnath, был выявлен в начале апреля 2019 г. Вирус этого генотипа продолжал циркулировать на территории Гродно и отдельных районов Гродненской области в течение 3,5 мес. (до середины июня). Источник завоза его завоза на территорию г. Гродно остался неустановленным. Согласно эпидемиологическим данным, имела место длинная цепочка передачи этого вируса, включавшая 21 студента из 2 студенческих общежитий (Гродненского государственного университета имени Янки Купалы и УО «Гродненский государственный медицинский университет»), жителей прилегающих к этим общежитиям районов, а также случаи К в других районах Гродненской области.
Заключение
Вспышка К возникла преимущественно среди взрослых, их доля составила 83,7%. Вакцинированы против К были 67,4% заболевших, при этом 86,2% из них получили вакцину 10 и более лет назад. Наиболее уязвимой группой стали работники лечебных учреждений и студенты-медики, составившие 41,7% среди взрослых и 34,9% от общего числа заболевших.
Клиническая картина К имела ряд особенностей: отмечено отсутствие или сокращение продолжительности продромального периода заболевания до 1–2 дней у 88,4% больных, отсутствие пятен Бельского–Филатова–Коплика у 65,1%, стадийности сыпи – у 48,8%. У привитых лиц К протекала в среднетяжелой и легкой форме К.
У детей по сравнению со взрослыми был сильнее выражен катаральный синдромом (чаще проявлялись кашель, насморк, конъюнктивит), выше была температура тела в продроме.
У непривитых лиц отмечена более высокая и продолжительная температурная реакция.
Для диагностики К у привитых заболевших недостаточно проведения исследований только на наличие IgM-антител, лишь сочетанное использование серологических и молекулярных методов дает возможность получить достоверные результаты для диагностики заболевания в хорошо вакцинированной популяции.
Вирусы К, вызвавшие вспышку заболеваемости в Гродненской области весной 2019 г., относились к 2 различным генотипам – B3 (выявлен у 3 из 11 обследованных пациентов) и D8, геновариант Gir Somnath (выявлен у 8 пациентов), что позволяет говорить о наложившихся по времени друг на друга 2 вспышках заболевания.


