В настоящее время предполагается, что под термином «иксодовые клещевые боррелиозы» (ИКБ) объединены 2 заболевания, развивающиеся после присасывания клеща. Этиология их различается: болезнь Лайма, вызываемая боррелиями группы B. burgdorferi sensu lato, характеризуется эритемой в месте присасывания, а заболевание, вызываемое В. miyamotoi, протекает, как правило, в безэритемной форме [1, 2]. В 1995 г. появилось первое сообщение об обнаружении на о. Хоккайдо (Япония) изолятов неизвестной спирохеты, которая была обнаружена в биологическом материале, собранном в период с 1990 по 1992 г. [3]: 3 из них выделены из голодных таежных клещей; 2 – из напитавшихся клещей, снятых с птиц; 1 – из клещей, снятых с грызуна. Обнаруженная новая спирохета была названа B. miyamotoi. Первооткрыватели тогда посчитали, что эта спирохета не имеет значения в патологии человека. Однако с 2009 г. стали появляться публикации об обнаружении нуклеиновых кислот В. miyamotoi в крови больных с нехарактерными для болезни Лайма рецидивирующими лихорадочными приступами, которые возникали после присасывания иксодовых клещей [1, 4, 5]. Позднее этот новый вид боррелии стали активно выделять из клещей и из крови пациентов в странах Европы [6] и в Северной Америке [7] на территориях обитания переносчиков – возбудителей болезни Лайма.
В 2006 г. была впервые выявлена ДНК B. miyamotoi у 6,3% клещей рода Ixodes, собранных на территории Удмуртии, и в крови пациентов с диагнозом «болезнь Лайма» [5, 8]. Затем было установлено, что данный возбудитель на территории Российской Федерации встречается в клещах I. ricinus в Московской и Липецкой областях и Ставропольском крае (1,2% случаев). Уровень зараженности клещей I. persulcarus B. miyamotoi составил в центральных областях РФ 1,9%, в Поволжье – 5,7%, на Урале – 2,9%, в Сибири – 3,3%. Причем одновременно на этих территориях до 62% клещей I. ricinus и до 35% I. persulcatus были инфицированы B. burgdorferi [9]. Генетический маркер B. miyamotoi в клещах и в крови лихорадящих больных в Новосибирске, а также в крови мелких грызунов в Западной Сибири выявляли, используя ПЦР-тест «РеалБест ДНК Borrelia miyamotoi» (АО «Вектор-Бест», Новосибирск) с последующим подтверждением с помощью секвенирования [10, 11]. Первые случаи выявления ДНК B. miyamotoi в иксодовых клещах на территории Дальнего Востока РФ были зарегистрированы в 2014 г. [12].
Молекулярно-генетический анализ В. miyamotoi показал принадлежность этого возбудителя к отдельной генетической ветви эволюционного дерева рода боррелий – группы возбудителей возвратных лихорадок [3, 13]. Borrelia miyamotoi, которая генетически группировалась с боррелиями возвратного тифа, была идентифицирована как патогенная для человека в России [1, 5], Соединенных Штатах [14–16], Европе [6] и Японии [17].
Цель настоящего сообщения – верификация B. miyamotoi в иксодовых клещах и крови пациентов, описание случаев заболевания на юге Дальнего Востока России.
Материалы и методы
В работе проведены результаты исследования материалов, собранных на юге Дальнего Востока в весенне-летние сезоны 2014 и 2015 гг.:
- 238 клещей I. persulcarus, собранных с растительности на о. Русском;
- 253 присосавшихся клещей I. persulcarus, снятых с пациентов;
- 168 лейкоцитарных фракций крови пациентов на 2–3-й день после присасывания клеща.
Каждого клеща гомогенизировали с помощью прибора TissueLyser LT («QIAGEN Hilden», Германия). Выделение нуклеиновых кислот для ПЦР проводили из индивидуальных суспензий клещей, лейкоцитарной фракции крови с использованием набора реагентов РНК/ДНК «РИБО-преп» (ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва) и набора «Реал¬Бест экстракция 100» (АО «Вектор-Бест», Новосибирск) согласно инструкциям производителей.
Для проведения ПЦР в режиме реального времени (ПЦР-РВ) использовали амплификатор с флуоресцентной детекцией «Rotor-Gene Q» («QIAGEN Hilden», Германия). Молекулярно-диагностические исследования проводили с помощью наборов реагентов серии «МультиПрайм» для амплификации фрагмента кДНК TBEV, B. burgdorferi s.l., A. phagocytophilum, E. chaffeensis/E. muris-FL (ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва), а также наборов реагентов для выявления ДНК B. miyamotoi «РеалБест ДНК Borrelia miyamotoi» (АО «Вектор-Бест», Новосибирск).

В качестве мишени в наборе «РеалБест ДНК Borrelia miyamotoi» для амплификации и последующего выявления участка ДНК B. miyamotoi был выбран фрагмент гена glpQ, который отсутствует у боррелий комплекса Borrelia burgdorferi s. l. (возбудителей ИКБ) и у других возбудителей клещевых инфекций, встречающих на территории РФ.
Для установления видовой принадлежности боррелии, ДНК которой была выделена из лейкоцитарной фракции крови пациента с лихорадкой (клиническое наблюдение № 1116) на 7-й день после присасывания клеща, была определена нуклеотидная последовательность в обеих цепях ДНК полиморфных участков гена glpQ. Амплификацию участков этого гена длиной в 680 п. н. проводили с использованием синтезированных праймеров для прямой (BMP-F2-5'-TGCTAGTGGGTATCTTCCAGAA) и обратной (BMP-R2-5'-TATCCAGG-GTCCAATTCCATCA) цепей. Последовательности исследовали на автоматическом секвенаторе «ABI Prism 3100 DNA Analyser» («Applied Biosystems», США) сотрудниками Межинститутского центра секвенирования ДНК СО РАН (Новосибирск). Секвенирование полученных образцов проводили в трех повторах по обеим цепям. Для филогенетического анализа полученных нуклеотидных последовательностей применяли программу MEGA 4.0 [18], а для их сравнения с данными GenBank – поисковую систему BLAST. В качестве положительного контроля для анализа длины нарабатываемых ампликонов по гену glpQ использовали ДНК B. miyamotoi, выделенную из клещей I. persulcatus, собранных в Новосибирской области [10].
Выявление антител классов IgM и IgG в образцах крови пациентов проводили методом ИФА с использованием тест-систем «Лайм-Бест-IgM» и «Лайм-Бест-IgG» (АО «Вектор-Бест», Новосибирск).
Статистическую обработку полученных данных проводили с помощью программы Excel.
Всеми пациентами подписана форма информированного согласия на основе положений Комитета по этике Медицинской ассоциации Дальневосточного отделения РАН (протокол № 19 от 30 апреля 2015 г.).
Результаты
 Настоящие исследования по выявлению РНК/ДНК возбудителей клещевых инфекций на территории юга Дальнего Востока охватили 2 эпидемических сезона 2014 и 2015 гг. В табл. 1 представлены результаты выявления генетического материала возбудителей пяти инфекций, которые передаются трансмиссивным путем иксодовыми клещами, из которых следует, что показатели обнаружения возбудителей клещевого энцефалита, A. phagocytophilum, E. chaffeensis/E. muris-FL невысоки. Высокие показатели в отношении B. burgdorferi s. l. выявлены в клещах, собранных с растительности (33,6%) и снятых с пациентов после присасывания (31,6%). ДНК этого возбудителя не была обнаружена в крови лиц на 2–3-й день после присасывания клеща. В то же время были выявлены показатели генетического маркера B. miyamotoi.
Настоящие исследования по выявлению РНК/ДНК возбудителей клещевых инфекций на территории юга Дальнего Востока охватили 2 эпидемических сезона 2014 и 2015 гг. В табл. 1 представлены результаты выявления генетического материала возбудителей пяти инфекций, которые передаются трансмиссивным путем иксодовыми клещами, из которых следует, что показатели обнаружения возбудителей клещевого энцефалита, A. phagocytophilum, E. chaffeensis/E. muris-FL невысоки. Высокие показатели в отношении B. burgdorferi s. l. выявлены в клещах, собранных с растительности (33,6%) и снятых с пациентов после присасывания (31,6%). ДНК этого возбудителя не была обнаружена в крови лиц на 2–3-й день после присасывания клеща. В то же время были выявлены показатели генетического маркера B. miyamotoi.
При анализе материалов, полученных в весенне-летний период 2015 г., в двух случаях обнаружено сочетанное инфицирование клеща (B. miyamotoi + B. burgdorferi s. l.). Мы обратили внимание на то, что показатели Ct ДНК B. burgdorferi s. l. (18 и 20) существенно превышали показатели Ct ДНК B. miyamotoi (36 и 36). Оба пациента никаких жалоб не предъявляли. В одном случае исследовали кровь спустя 1 мес. после присасывания клеща, антитела IgM и IgG к B. burgdorferi s. l. не выявлены. Для контроля кровь этого пациента была еще раз исследована через 4 мес. после присасывания. Несмотря на то что пациент не предъявлял жалоб и в его крови ДНК боррелий и антитела IgM не были выявлены, были обнаружены антитела IgG.
В другом случае при исследовании клеща, снятого с пациента 25.04.2015, была выявлена ДНК только B. miyamotoi (Ct 30). Спустя 6 мес. в крови пациента ДНК B. miyamotoi не была обнаружена, но были выявлены антитела класса IgG.
Всего в 2015 г. ДНК B. miyamotoi выявили в 6 клещах, снятых с пациентов, и в крови 4 человек на 2–3-й день после присасывания клеща. Среди пострадавших было двое детей в возрасте 3 лет и 8 взрослых (5 мужчин и 3 женщины) в возрасте от 20 до 65 лет. Заболели 2 пациента.
Клиническое наблюдение (№ 24). Женщина 43 лет была госпитализирована в инфекционный стационар на 2-й день болезни (через 12 дней после снятия клеща). Заболевание характеризовалось острым началом, лихорадкой, интоксикационным синдромом (головной болью, головокружением, полиартралгией и миалгией, слабостью, плохим сном, тошнотой, отсутствием аппетита). В гемограмме выявлены лейкопения (3,8 х 109 г/л), относительный лимфоцитоз (54%), тромбоцитопения (100 х1012 г/л), цитолиз (АЛТ – 76 Ед/л, АСТ – 69 Ед/л). Учитывая указания в анамнезе на присасывание клеща, кровь больной исследовали на клещевые инфекции. В крови антитела к вирусу клещевого энцефалита и B. burgdorferi s. l. не обнаружены. На 3-й день болезни обнаружена ДНК B. miyamotoi (Ct = 35). После назначения курса цефтриаксона и десенсибилизирующих средств состояние быстро улучшилось, лихорадка критически снизилась. Больная выписана клинически здоровой.
Клиническое наблюдение (№ 1116). Ребенок 3 лет, у которого присасывание клеща зарегистрировано 02.06.2015 г. на территории Ботанического сада (пригород Владивостока). Клещ не был исследован. На 7-й день после присасывания в лейкоцитарной фракции крови больного методом ПЦР-РВ была детектирова-на ДНК B. miyamotoi (Ct = 34). Методом ИФА ДНК B. burgdorferi s. l. и антитела к боррелиям и вирусу клещевого энцефалита в крови не обнаружены. Через 2 недели после снятия клеща появилась кратковременная лихорадка до 39 °С и катаральный синдром (насморк, заложенность носа, кашель, гиперемия слизистых оболочек ротоглотки). Продолжительность заболевания составила около 5 дней. К врачам родители не обращались, ребенка лечили домашними средствами. Повторное исследование крови было проведено спустя 5 мес. после присасывания клеща и было связано это с тем, что у ребенка периодически отмечалась субфебрильная температура, недомогание, катаральные явления в ротоглотке. В крови ребенка ДНК B. miyamotoi не выявлена, но сыворотка крови была позитивна к боррелиям (IgM –1,28; IgG не обнаружены). После лечения антибиотиками и применения десенсибилизирующих средств наступило выздоровление.
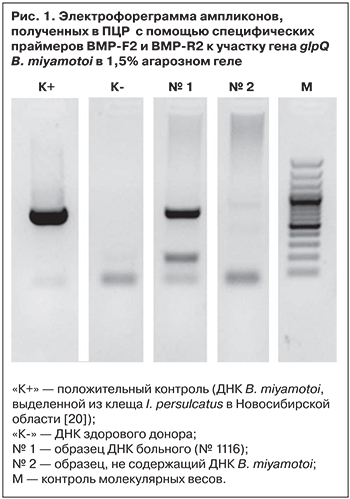
Из лейкоцитарной фракции крови ребенка повторно выделили ДНК, которая затем была амплифицирована с помощью синтезированных праймеров BMP-F2 и BMP-R2 по обеим цепям ДНК участка гена glpQ B. miyamotoi. На электрофореграмме показана наработка ампликонов (680 п. н.) участка гена glpQ (рис. 1). Данные этой электрофореграммы подтвердили результаты ПЦР-анализа.
Проведено секвенирование продуктов амплификации по участку гена glpQ образца (№ 1116) длиной 680 п. н. Последовательность, зарегистрированная в GenBank (accession KU169374, VL1116-patient), показала генетические отличия от B. burgdorferi s. l. и сходство с боррелиями группы возбудителей возвратных лихорадок.
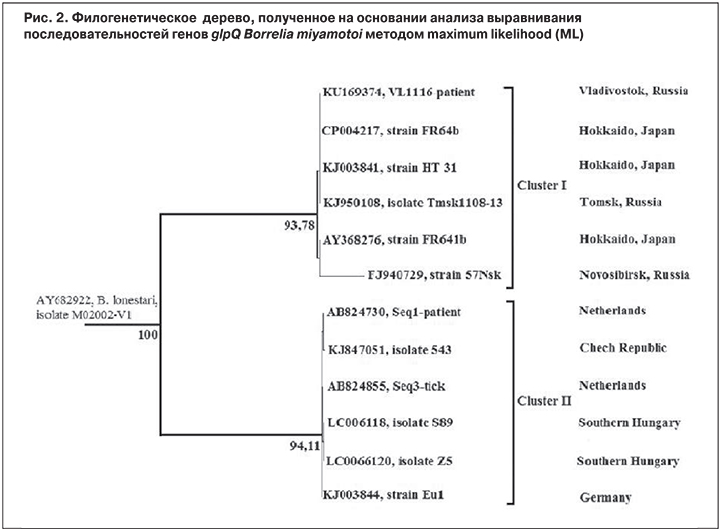
Филогенетический анализ показал генетическую близость ДНК образца № 1116 к изолятам B. miyamotoi, выделенным в Японии, Европе, Америке и в Сибири (рис. 2). Боррелии, передаваемые клещами Ixodes persulcatus, оказались сходными с боррелиями группы возбудителей возвратных лихорадок и расположились в кластере I, а боррелии, передаваемые клещами Ixodes ricinus – в кластере II.
Обсуждение
В работе представлены результаты исследования различных биологических материалов (голодные клещи, собранные с растительности; присосавшиеся клещи, снятые с пациентов; лейкоцитарная фракция крови людей после снятия присосавшегося клеща), полученных на юге Дальнего Востока. С помощью ПЦР-РТ мы впервые показали существование комплекса пяти возбудителей клещевых инфекций (болезни Лайма, клещевого энцефалита, гранулоцитарного анаплазмоза человека, моноритарного эрлихиоза человека и клещевой возвратной лихорадки, вызванной B. miyamotoi). Чаще всего встречалась зараженность клещей боррелиями (B. burgdorferi s. l. и B.miyamotoi). Реже выявляли нуклеиновые кислоты вируса клещевого энцефалита, анаплазм и эрлихий. Наше внимание было сосредоточено на новой для изучаемой территории клещевой инфекции, вызываемой B. miyamotoi. При высоких показателях выявления возбудителей болезни Лайма в клещах, собранных с растительности (33,6%), и клещах, присосавшихся к людям (31,6%), в крови пациентов в начальной стадии инфекционного процесса (чаще на 2–3-й день после присасывания клеща) ни в одном случае не удалось выявить ДНК B. burgdorferi s. l. Это связано с тем, что в начальный период инфицирования возбудители болезни Лайма локализуются в кожных покровах места присасывания клеща. В то же время другая спирохета B. miyamotoi, которая, предположительно, не формирует депо возбудителя в кожных покровах, вследствие чего, по-видимому, и не образует патогномоничного признака для ИКБ – мигрирующей эритемы, сразу после присасывания клеща проникает в кровь пациента и вызывает генерализованную форму инфекции [1]. Доказательством тому явились исследования, проведенные на диких мышах, у которых B. miyamotoi идентифицировали в биоптатах кожи только в 2% случаев, в то время как в 76% случаев результаты были положительными для B. burgdorferi [19]. Об этом же свидетельствуют факты выявления нами ДНК B. miyamotoi в крови людей уже на 2–3-й день после присасывания клеща (4,1% случаев), а также на 7-й день (конец инкубационного периода) и на высоте лихорадочного периода. В Новосибирской области в крови таких пациентов в лихорадочный период обнаруживали B. miyamotoi в 15% случаев [4].
Молекулярно-генетическая диагностика с использованием ПЦР-РТ, электрофореза и секвенирования фрагмента ДНК гена glpQ, характерного только для B. miyamotoi, но отсутствующего у B.burgdorferi s. l. и у возбудителей других клещевых инфекций, встречающихся на территории РФ, подтвердила этиологию описанных случаев заболевания: они были вызваны спирохетой B. miyamotoi. Циркуляция этого нового возбудителя на изучаемой территории, близко прилежащей к территории Хоккайдо (Япония) и похожей по условиям существования природных очагов клещевых инфекций, указывает на генетическое родство изолятов этого возбудителя, которые расположились также рядом на филогенетическом дереве (см. рис. 2).
Случаи заболевания, вызванного B. miyamotoi, уже описаны в России, США, Нидерландах, Японии. Они характеризовались полиморфизмом клинической картины этой инфекции. Типичными для течения заболевания, вызванного В. miyamotoi, являются лихорадка до 40 °С и, как следствие, проявления интоксикации: головная боль, слабость, миальгии, рвота и др. [20]. Возможны также катаральный синдром, лимфаденопатия, нарушение сна, сегментарная гиперемия кожи плечевого пояса [1, 2, 21].
Отмечаются тромбоцитопения, лейкопения с относительным лимфоцитозом. В ряде случаев, по невыясненным до конца причинам, в патологический процесс вовлекаются внутренние органы (легкие, печень, почки, ЖКТ, сердце), поражения которых могут доминировать, затрудняя клиническую диагностику клещевой инфекции, и стать причиной диагностической ошибки.
Приведенные клинические наблюдения свидетельствуют также о ранней генерализации инфекции, вызванной B. miyamotoi, в отличие от ИКБ, ассоциированного с B. burgdorferi s. l. При этом ни в одной из 168 проб крови, взятых в ранние сроки после присасывания клеща, ДНК B. burgdorferi s. l. не была обнаружена. Типичное клиническое течение, характерное для клещевых возвратных лихорадок, мы наблюдали у 3-летнего ребенка (наблюдение № 1116), которому в острый период заболевания не было проведено полноценного лечения. Произошло рецидивирование инфекции, подтвержденное выявлением антител IgM. Серологические тесты для определения IgM и IgG к боррелиям диагностируют и B. miyamotoi на основании общих для боррелий белковых антигенов [13].
Отсутствие клинических проявлений заболевания у остальных пациентов, у которых ДНК B. miyamotoi выделена из материала клещей, может быть связано с рядом причин: проведением антибиотикопрофилактики (доксициклином) после присасывания клеща у двух пациентов, низкой дозой инфекта в клеще, а также наличием коинфицирования клеща (B. burgdorferi s. l. + B. miyamotoi) в двух случаях. Конкуренция возбудителей пока не изучена; вероятно, она также может влиять на манифестацию болезни.
Зачастую пациенты игнорируют описанные симптомы и не обращаются к врачам для поведения квалифицированной диагностики и лечения малоизвестного заболевания, поэтому при регистрации могут не учитываться даже тяжелые случаи инфекции [6]. Проведение ретроспективных исследований позволило установить 2 случая инфекции, вызванной B. miyamotoi, в Японии [17]. Исследователи разных стран, изучая сыворотки крови доноров, обнаруживали антитела к B. burgdorferi и B. miyamotoi [20]. P.J. Krause и соавт. [22] провели интересные экспериментальные наблюдения на мышах. В течение 28 дней микроскопически наблюдали подвижные спирохеты в крови иммунокомпетентных мышей и мышей-реципиентов с иммунодефицитом после переливания мышиный B. miyamotoi-инфицированной крови. Приведенные данные свидетельствуют о том, что такая передача B. miyamotoi может происходить и в организме человека при переливании крови, инфицированной этим возбудителем, провоцируя безэритемные формы возвратных лихорадкок. Об этом необходимо знать для проведения целенаправленных диагностических исследований [23].
Заключение
Наши исследования впервые выявили существование в природных очагах на Дальнем Востоке сочетания возбудителей клещевых инфекций, среди которых велика роль не только известных здесь боррелий, вызывающих болезнь Лайма, но и новой, ранее не описанной B. miyamotoi. Исследования в этом направлении следует продолжать, чтобы получить более полные представления о значении B. miyamotoi в патологии человека на изучаемой территории.


