Одним из самых распространенных микозов является инвазивный кандидоз (ИК): показатель заболеваемости им составляет 2,4–29 на 100 тыс. населения в год. Ежегодно в мире регистрируется более 400 000 случаев этого заболевания [1].
Частота микотических инфекций, вызванных Candida spp., в медицинских организациях растет за счет увеличения продолжительности пребывания пациентов в стационаре, старения популяции больных, применения инвазивных вмешательств [катетеров, протезной техники, искусственной вентиляции легких (ИВЛ), парентерального питания, гемодиализа и др.], а также длительного использования антибактериальной терапии и глюкокортикостероидов [2–5]. По данным зарубежной литературы [6], факторами риска развития ИК являются хирургические вмешательства (перенесенные операции на органах желудочно-кишечного тракта, перитонит), нейтропения, онкологические и гематологические заболевания, ожоги, длительное пребывание в отделении реанимации и интенсивной терапии (ОРИТ) и тяжесть состояния больного. Кроме того, риск развития микотической инфекции представляет поверхностная колонизация грибами Candida spp. [7–9].
У больных ВИЧ-инфекцией кандидоз любой локализации является наиболее ранним оппортунистическим заболеванием [10–12]. Генерализованная кандидозная инфекция характеризуется тяжелым течением и высокой (до 40%) летальностью, причины которой кроются в позднем выявлении заболевания вследствие неспецифичности клинических проявлений, трудностях дифференцирования бактериальных и грибковых заболеваний и лабораторной диагностики [13]. В связи с этим для прогнозирования развития и ранней диагностики ИК у больных ВИЧ-инфекцией большое значение имеют знания о факторах риска заболевания, имеющих прямую связь с вероятностью его развития, которые в литературе не описаны.
Цель исследования – выявление факторов риска и вероятного развития ИК у больных ВИЧ-инфекцией.
Материалы и методы
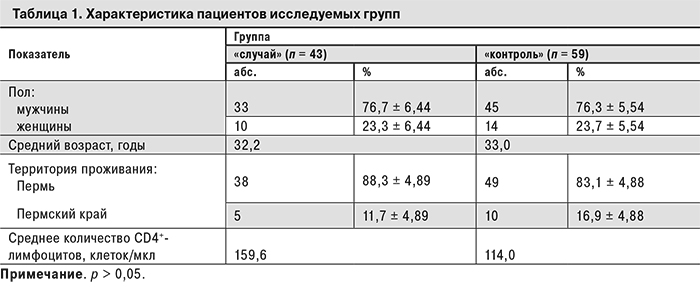
Изучение факторов риска развития ИК проводили методом «случай–контроль» в специализированном отделении для лечения ВИЧ-инфицированных пациентов Пермской краевой клинической инфекционной больницы в 2012–2014 гг. В группу «случай» вошли 43 пациента с подтвержденным диагнозом ИК (по критериям ESCMID Guideline for the Diagnosis and Management of Candida Diseases, 2012 г.). В контрольную группу вошли 59 пациентов без ИК. Группы были сопоставимы по полу, возрасту, территории проживания, стадии ВИЧ-инфекции (стадия 4 – стадия вторичных заболеваний согласно классификации В.И. Покровского, 2001 [14]), количеству CD4-лимфоцитов < 350 клеток/мкл, отсутствию антиретровирусной терапии (АРТ) (табл. 1).
Факторы риска, ассоциированные с вероятностью развития ИК, были изучены на основе экспертизы медицинских карт стационарного больного (форма № 003/у), амбулаторных карт пациентов (форма № 025/у-04), клинико-лабораторного обследования (микробиологические/микологические исследования крови и других «стерильных» и «нестерильных» в норме биосубстратов), патоморфологических методов.
Статистическую обработку результатов проводили с использованием пакета статистических программ «Microsoft Excel 2003» и программы Statistica 6.0. При анализе полученных результатов определяли среднее арифметическое (M) и его ошибку (m). Достоверность различий показателей в контрольной и опытной группах определяли с помощью t-критерия Стьюдента и критерия χ2 Пирсона. При p < 0,05 делали вывод о наличии статистически значимой разницы между сравниваемыми показателями. Связь между изучаемым исходом (наличием инвазивного кандидоза) и исследуемыми факторами риска оценивали при помощи показателя отношения шансов (OШ).
Результаты и обсуждение
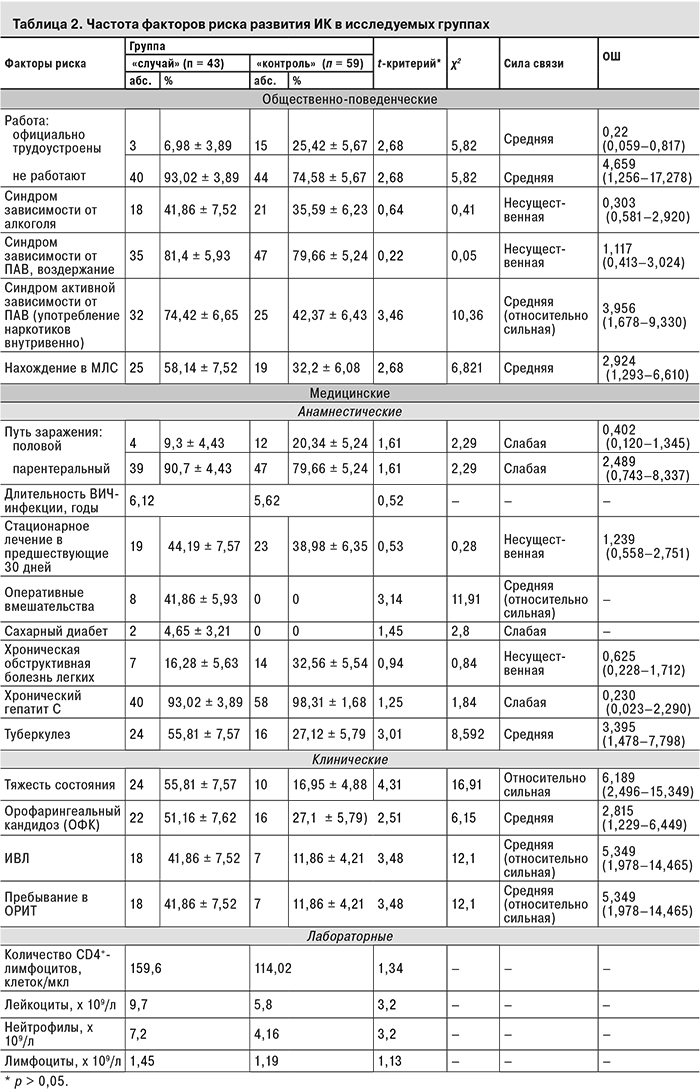
Изучали 2 группы факторов риска развития ИК: медицинские (путь заражения ВИЧ-инфекцией и ее длительность; наличие хронической обструктивной болезни легких, сахарного диабета, хронического гепатита С, орофарингеального кандидоза, туберкулеза; оперативные вмешательства и стационарное лечение в течение 30 дней до госпитализации; тяжесть состояния пациента; пребывание в ОРИТ; ИВЛ; количество лейкоцитов, нейтрофилов и лимфоцитов в периферической крови) и общественно-поведенческие [трудоустройство, нахождение в местах лишения свободы (МЛС), зависимость от психоактивных веществ (ПАВ)]. При оценке синдрома зависимости от ПАВ учитывали вид зависимости (алкогольная или наркотическая) и клиническую форму зависимости согласно МКБ-10 (активная зависимость с употреблением наркотических веществ внутривенно и период воздержания) (табл. 2).
Как показали проведенные исследования, в группе пациентов с ИК достоверно чаще были отмечены такие факторы, как пребывание в ОРИТ, предшествующие оперативные вмешательства на органах желудочно-кишечного тракта (ЖКТ), применение ИВЛ, тяжелое состояние. Согласно данным литературы [6, 15], эти факторы рассматриваются как факторы риска развития ИК и у пациентов без ВИЧ-инфекции. Среди других медицинских факторов, достоверно чаще встречающихся только у ВИЧ-инфицированных с ИК, можно выделить орофарингеальный кандидоз (ОФК) и туберкулез. Полученные результаты свидетельствуют о наличии прямой связи (средней силы) между этими признаками и вероятностью развития ИК.
Наличие сахарного диабета, хронической обструктивной болезни легких и стационарное лечение в предшествующие госпитализации 30 дней с одинаковой частотой отмечены у пациентов обеих групп, из чего можно заключить, что они не оказывают значимого влияния на вероятность развития ИК у ВИЧ-инфицированных. У пациентов же без ВИЧ-инфекции они рассматриваются как факторы риска [13].
Вместе с тем установлено, что на возможность развития ИК у ВИЧ-инфицированных не оказывают влияния такие факторы, как путь заражения и длительность ВИЧ-инфекции.
В ходе исследования были выявлены достоверные различия в частоте встречаемости и так называемых общественно-поведенческих факторов (см. табл. 2). Выявлена прямая связь средней силы между возникновением ИК у ВИЧ-инфицированных пациентов с активной формой зависимости от ПАВ (употребление наркотиков внутривенно), так как подобный асоциальный образ жизни приводит к снижению уровня дохода, неполноценному питанию, провоцирует конфликты в семье и стрессовые ситуации, что неизбежно способствует развитию иммуносупрессии. У пациентов, находившихся на момент исследования в стадии воздержания от употребления ПАВ, достоверных различий не получено.
 Известно, что в защите от кандидоинфекции основную роль играет клеточный иммунитет, принимающий активное участие в ограничении распространения и уничтожении клеток Candida spp. [16]. Снижение уровня нейтрофилов у пациентов с онкологическими, гематологическими и другими заболеваниями может способствовать развитию тяжелых форм кандидоза [8]. У обследуемых нами ВИЧ-инфицированных больных нейтропении не наблюдалось. Следует отметить, что количество нейтрофилов и лейкоцитов в крови пациентов с ИК существенно превышало аналогичные показатели в контрольной группе, однако эти признаки не были отобраны нами для дальнейшего изучения, так как их значения соответствуют норме и не входят в диагностические критерии системной воспалительной реакции [17]. Поэтому не представляется возможным говорить о нейтропении как о факторе риска развития ИК у ВИЧ-инфицированных.
Известно, что в защите от кандидоинфекции основную роль играет клеточный иммунитет, принимающий активное участие в ограничении распространения и уничтожении клеток Candida spp. [16]. Снижение уровня нейтрофилов у пациентов с онкологическими, гематологическими и другими заболеваниями может способствовать развитию тяжелых форм кандидоза [8]. У обследуемых нами ВИЧ-инфицированных больных нейтропении не наблюдалось. Следует отметить, что количество нейтрофилов и лейкоцитов в крови пациентов с ИК существенно превышало аналогичные показатели в контрольной группе, однако эти признаки не были отобраны нами для дальнейшего изучения, так как их значения соответствуют норме и не входят в диагностические критерии системной воспалительной реакции [17]. Поэтому не представляется возможным говорить о нейтропении как о факторе риска развития ИК у ВИЧ-инфицированных.
При сравнении общего количества лимфоцитов и CD4+-лимфоцитов в периферической крови достоверных различий в опытной и контрольной группах не получено.
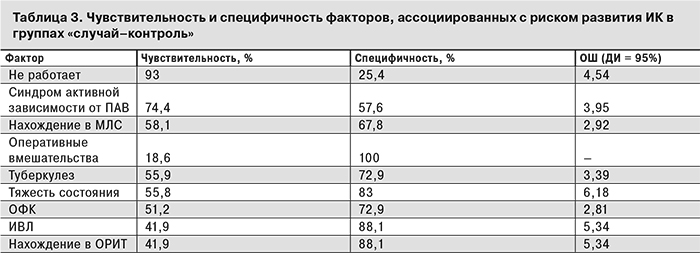
Таким образом, среди изучаемых факторов риска 9 имели достоверные различия в частоте встречаемости в обеих группах. При этом ни один из перечисленных факторов изолированно не обладал одновременно высокой чувствительностью и специфичностью (табл. 3).
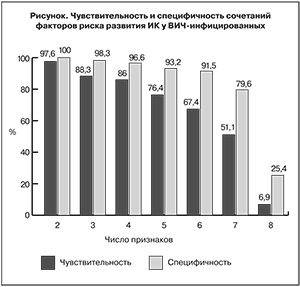
В связи с этим нами была изучена возможность использования сочетания этих факторов (см. рисунок).
Установлено, что риск развития ИК значительно возрастает при сочетании нескольких факторов. Сочетание 3 признаков давало одновременно высокие показатели чувствительности (88,3%) и специфичности (98,3%). При сочетании 4 и более признаков показатели чувствительности и специфичности существенно снижались. Таким образом, наличие у ВИЧ-инфицированных не менее 3 признаков из 9 является оптимальным способом ранней диагностики вероятного развития у них ИК.
Нами выявлены наиболее значимые комбинации факторов риска: наличие туберкулеза, отсутствие постоянного места работы и нахождение в МЛС (у 41,8% обследованных в опытной группе); наличие ОФК, активной формы зависимости от ПАВ (внутривенное употребление наркотиков) и отсутствие постоянного места работы (у 39,5%); наличие туберкулеза, активной формы зависимости от ПАВ (внутривенное употребление наркотиков) и отсутствие постоянного места работы (у 37,2%); наличие ОФК, туберкулеза и отсутствие постоянного места работы (у 32,5%). Обращает на себя внимание тот факт, что среди них всегда присутствуют общественно-поведенческие факторы, такие как активная форма зависимости от ПАВ (внутривенное употребление наркотических веществ), нахождение в МЛС, а также наличие туберкулеза в анамнезе. Это позволяет уже при первичном осмотре ВИЧ-инфицированного пациента выявить высокий риск возникновения у него ИК без применения дорогостоящих и трудоемких методов обследования и выиграть время для проведения профилактических и лечебных мероприятий.
Таким образом, впервые описаны факторы, ассоциированные с вероятностью риска развития ИК у ВИЧ-инфицированных, как медицинские (наличие ОФК и туберкулеза, нахождение в ОРИТ, ИВЛ, предшествующие операции на ЖКТ), так и общественно-поведенческие [активная форма зависимости от ПАВ (внутривенное употребление наркотиков), нахождение в МЛС, отсутствие постоянного места работы].
Обнаружена полифакторность при возникновении ИК у больных ВИЧ-инфекцией. Наиболее значимыми комбинациями являются:
- наличие туберкулеза, отсутствие постоянного места работы и нахождение в МЛС;
- наличие ОФК, активной формы зависимости от ПАВ (внутривенное употребление наркотиков) и отсутствие постоянного места работы;
- наличие туберкулеза, активной формы зависимости от ПАВ (внутривенное употребление наркотиков) и отсутствие постоянного места работы.
Наиболее вероятен ИК у пациентов со стадиями ВИЧ-инфекции 4Б и 4В, количеством CD4+-лимфоцитов < 350 клеток/мкл, без АРТ при наличии не менее 3 из следующих признаков: тяжелое состояние пациента, ОФК, пребывание в ОРИТ, применение ИВЛ, предшествующие госпитализации операции на ЖКТ, туберкулез, отсутствие постоянного места работы, активная форма зависимости от ПАВ (употребление наркотиков внутривенно), нахождение в МЛС до госпитализации.
Выявленные факторы могут быть использованы врачами специализированных медицинских организаций для прогнозирования риска развития ИК у ВИЧ-инфицированных больных, проведения своевременного обследования, ранней диагностики и выбора адекватной терапии.


