В ХХI веке хронические вирусные гепатиты приобрели глобальное распространение с неуклонной тенденцией к росту. Для большинства стран мира вирусные гепатиты являются большой медицинской, социальной и экономической проблемой. Россия входит в число стран с высоким уровнем заболеваемости хроническими вирусными гепатитами, особенно хроническим гепатитом С (ХГC) [1, 2].
Число пациентов, инфицированных вирусом гепатита С (ВГС) в мире, превышает 170 млн человек, ежегодно от гепатита С умирают более 350 тыс. человек. В России насчитывается более 4 млн больных ХГС, что составляет около 3% от общей популяции [3, 4].
Именно ВГС-инфекция является основной причиной формирования всей группы хронических болезней печени. Это вызвано тем, что ВГС способен ускользать от иммунного контроля, создавая новые генетические и антигенные варианты, а также задерживая формирование Т-хелперного и Т-киллерного ответа при остром гепатите С, что способствует переходу в хронический гепатит, вызывая повторную реинфекцию у выздоровевших людей [5–7].
 Высокий процент хронизации заставляет исследователей задумываться об эффективных средствах борьбы с ХГС. В настоящее время проводятся широкие дискуссии о правильном выборе препаратов, доз, схем лечения, критериев оценки проведенной терапии. Однако следует признать, что, несмотря на появление все более новых препаратов для лечения больных ХГС, эффективность терапии для некоторых групп пациентов еще недостаточна [8, 9]. Известно, что на конечные результаты противовирусного лечения влияет множество факторов как со стороны вируса (генотип, вирусная нагрузка), так и со стороны «хозяина» (состояние иммунной системы, генетические особенности) [10–13]. Все эти факторы особое значение приобретают при естественном течении заболевания. Однако данные литературы по комплексному исследованию этих факторов в отдалённом периоде при естественном течении ХГС немногочисленны и представляют интерес.
Высокий процент хронизации заставляет исследователей задумываться об эффективных средствах борьбы с ХГС. В настоящее время проводятся широкие дискуссии о правильном выборе препаратов, доз, схем лечения, критериев оценки проведенной терапии. Однако следует признать, что, несмотря на появление все более новых препаратов для лечения больных ХГС, эффективность терапии для некоторых групп пациентов еще недостаточна [8, 9]. Известно, что на конечные результаты противовирусного лечения влияет множество факторов как со стороны вируса (генотип, вирусная нагрузка), так и со стороны «хозяина» (состояние иммунной системы, генетические особенности) [10–13]. Все эти факторы особое значение приобретают при естественном течении заболевания. Однако данные литературы по комплексному исследованию этих факторов в отдалённом периоде при естественном течении ХГС немногочисленны и представляют интерес.
В связи с этим целью данной работы было выявление клинико-лабораторных особенностей естественного течения ХГС.
Материалы и методы
В отдаленном периоде было обследовано 45 больных с естественным течением ХГС, не получавших противовирусной терапии. Среди них преобладали пациенты в возрасте до 40 лет – 68,9%, лиц старше 61 года было всего 2,2%; число мужчин и женщин было практически одинаково –53,3 и 46,7% соответственно. Достоверно больше было больных с генотипом 1 – 28 (62,2%) человек против 17 (37,8%) человек с генотипом «не 1» (p < 0,01). Из 45 больных 34 (75,5%) имели сопутствующие заболевания: 14 человек (41,2%) – болезни желудочно-кишечного тракта и 12 человек (35,3%) – аллергические заболевания. Из болезней желудочно-кишечного тракта чаще регистрировали хронический гастрит, язвенную болезнь желудка и/или двенадцатиперстной кишки и синдром Жильбера. Из аллергических заболеваний чаще отмечали сезонный аллергический риноконъюнктивит и контактный дерматит.
Группу сравнения составили 30 здоровых доноров, не отличавшихся от больных по полу и возрасту, давших информированное согласие на обследование и не имевших в анамнезе сведений, позволяющих причислить их к категории часто болеющих лиц. У них отсутствовали признаки инфекционно-воспалительных, аутоиммунных и иммунодефицитных состояний, а также, по данным анамнеза и результатам серологических, биохимических и ПЦР исследований – вирусные гепатиты иной этиологии или другие заболеваний печени.
Для решения поставленных в работе задач были использованы следующие методы исследования:
- Клинические. Общее клиническое обследование (осмотр, пальпация, ведение истории болезни, общий анализ крови, общий анализ мочи).
- Биохимические. Всем пациентам проводили общепринятые биохимические исследования, включавшие определение уровня аланинаминотрансферазы – АЛТ (норма для мужчин – 10–40 Ед/л, для женщин – 7–35 Ед/л), аспартатаминотрансферазы – АСТ (норма для мужчин – 15–40 Ед/л, для женщин – 13–35 Ед/л), щелочной фосфатазы – ЩФ (норма для мужчин – 53–128 Ед/л, для женщин – 42–98 Ед/л), гамма-глютамилтранспептидазы – ГГТП (норма для мужчин – < 49 Ед/л, для женщин – < 32 Ед/л); билирубин общий (норма – 5,00–21,00 ммоль/л) и прямой (норма – < 8,6 ммоль/л).
- Иммунологические. Сыворотка крови была исследована на специфические маркеры гепатитов В, С, D методом твердофазного иммуноферментного анализа (ИФА; ELISA-тест) на спектрофотометре Multiscan Rc («Labsystems», Финляндия).
- Молекулярно-генетические. Количественный анализ РНК ВГС в сыворотке крови проводили методом ПЦР в лаборатории Центрального НИИ эпидемиологии Роспотребнадзора (ЦНИИЭ) с использованием тест-системы АмплиСенс HCV-Монитор (ЦНИИЭ, Москва). Генотипирование ВГС проводили методом ПЦР с помощью коммерческой тест-системы АмплиСенс HCV-генотип (ЦНИИЭ, Москва). В основе принципа генотипирования лежит амплификация с праймерами, специфичными для разных генотипов.
- Инструментальные. Для выявления поражения внутренних органов и систем проводили инструментальные исследования: ультразвуковое исследование органов брюшной полости, фиброэластометрию печени, ЭКГ. Для оценки активности процесса в печени применялся индекс фиброза в соответствии со стандартизированной системой Metavir (1994): F0 – отсутствие фиброза, F1 – слабый (портальный фиброз), F2 – умеренный (с порто-портальными септами), F3 – тяжелый (с порто-центральными септами), F4 – цирроз.
- Статистические. Статистическую обработку результатов проводили с помощью лицензированных программ IBM SPSS Statistics 21.0 и статистического модуля программы Microsoft Excel 2010. Определяли процентное выражение ряда данных, среднюю арифметическую, стандартную ошибку средней арифметической, среднеквадратическое отклонение. Для оценки статистической значимости различий между независимыми выборками использовался U-критерий Манна–Уитни и t-критерий Стьюдента, между связанными выборками – W-критерий Вилкоксона. Для корреляционного анализа применяли методы Спирмена и Пирсона.
Результаты и обсуждение
 Длительность наблюдения за больными с естественным течением ХГС колебалась в диапазоне от 1 года до 16 лет и составила в среднем 6,87 ± 1,02 года.
Длительность наблюдения за больными с естественным течением ХГС колебалась в диапазоне от 1 года до 16 лет и составила в среднем 6,87 ± 1,02 года.
Клиническая картина ХГС естественного течения характеризовалась небольшим количеством симптомов: слабость наблюдалась у 7 (15,6%) человек, тошнота – у 1 (2,2%) пациента; чаще всего регистрировались вторичные печеночные знаки – у 29 (64,5%) человек, увеличение печени – у 15 (33,3%), селезенки – у 1 (2,2%) пациента.
Активность основных печеночных ферментов при ХГС естественного течения регистрировалась достоверно выше, чем у здоровых лиц. Так, уровень АЛТ был 71,45 ± 11,01 Ед/л против 20,6 ± 1,54 Ед/л в контрольной группе (р < 0,003).
В связи с тем, что стандартное отклонение по некоторым показателям было больше средней арифметической, была проанализирована активность основного печеночного фермента АЛТ в зависимости от степени ее повышения: в пределах нормы, выше нормы (< 3N) и > 3N. Как выяснилось, уровень АЛТ регистрировался в пределах нормальных величин у 22 (48,9%) больных, < 3N – у 16 (35,6%) и только у 7 (15,5%) пациентов он был > 3N. Таким образом, большинство больных ХГС с естественным течением имели нормальный и умеренно повышенный уровень АЛТ.
Сроки постановки диагноза ХГС достоверно различались в зависимости от сроков выявления анти-ВГС и возможного заражения по длительности эпидемиологического анамнеза – 6,64 ± 0,68 года против 16,2 ± 1,25 года соответственно (р < 0,001. Следовательно, сроки постановки диагноза по обнаружению антител запаздывали на 10 лет. В связи с этим у больных ХГС была отдельно проанализирована активность АЛТ в зависимости от продолжительности болезни, согласно эпидемиологическим данным и срокам выявления анти-ВГС.
Максимальная активность АЛТ (114,71 ± 34,18 Eд/л) выявлена при длительности заболевания 6–10 лет, однако значимой разницы по уровню основного печеночного фермента в зависимости от длительности хронического процесса не обнаружено. Активность АСТ значительно не изменялась.
Кроме того, была проанализирована активность АЛТ и АСТ в зависимости от длительности заболевания и сроков выявления анти-ВГС. Не выявлено достоверной разницы в активности основных печеночных ферментов в зависимости от длительности заболевания (по выявлению антител, также как и по данным эпидемиологического анамнеза). Важно подчеркнуть, что имеется тенденция к снижению уровня АЛТ при увеличении продолжительности гепатита: 71,37 ± 15,92 Ед/л при длительности заболевания 1–5 лет и 81,69 ± 20,55 Ед/л – от 5 до 10 лет против 45,33 ± 11,52 Ед/л при естественном течении ХГС более 10 лет.
Активность АСТ оставалась одинаковой в разные периоды наблюдения, поэтому представлялось целесообразным провести индивидуальный анализ только активности АЛТ и выявить удельный вес больных с нормальной и повышенной активностью этого фермента при разной длительности ХГС.
Нормальная активность АЛТ была у 21 больного, из них у 9 (42,9%) длительность заболевания составила 1–5 лет, у 7 (33,3%) – от 5 до 10 лет и только у 5 (23,8%) – свыше 10 лет. У половины пациентов, имеющих как умеренно повышенную, так и высокую (> 3N) активность АЛТ, длительность гепатита составила свыше 5–10 лет.
 Таким образом, максимальная активность АЛТ, отражающая степень цитолиза гепатоцитов как по ее выраженности, так и по удельному весу, приходилась на период от 5 до 10 лет. С увеличением длительности ХГС уровень АЛТ уменьшался даже при отсутствии противовирусной терапии.
Таким образом, максимальная активность АЛТ, отражающая степень цитолиза гепатоцитов как по ее выраженности, так и по удельному весу, приходилась на период от 5 до 10 лет. С увеличением длительности ХГС уровень АЛТ уменьшался даже при отсутствии противовирусной терапии.
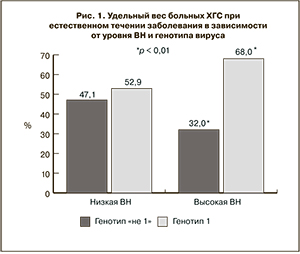
Был проведен анализ взаимосвязи вирусной нагрузки (ВН) и генотипа ВГС. ВН была определена у 42 человек.
Как представлено на рис. 1, низкая ВН была практически у одинакового числа больных ХГС с генотипами 1 и «не 1». Высокая ВН в 2 раза чаще регистрировалась у пациентов с ХГС генотипа 1, чем с ХГС генотипа «не 1» – 17 (68%) человек против 8 (32%) (р < 0,01).
Активность АЛТ была достоверно связана со степенью ВН (рис. 2). Из 8 больных ХГС с высокой (> 3N) активностью АЛТ у 7 (87,5%) была высокая ВН и только у 1 (12,5%) – низкая (p < 0,001). Кроме того, при низкой ВН число больных с нормальной и умеренной активностью АЛТ было достоверно больше по сравнению с пациентами, у которых уровень АЛТ > 3N – 16 (94,1%) человек против 1 (5,9%) (р < 0,001).
Следовательно, степень ВН у больных при естественном течении ХГС выше при генотипе 1 вируса и высоком уровне АЛТ.
УЗИ было проведено 35 больным. Увеличение печени было у 6 (17%) человек, увеличение селезенки – у 4 (11,4%). У 2 больных ХГС при одновременном увеличении печени и селезенки при фиброэластометрии выявлена 4-я стадия фиброза (F4).
Транзиентная фиброэластометрия проведена 37 из 45 больных. Из них фиброз печени в стадии F0 выявлен у 18 (48,7%) больных, F1 – у 10 (27,0%), F2 – у 4 (10,8%), F3 – только у 1 (2,7%), а F4 – у 4 (10,8%) пациентов. Таким образом, у большинства (75,7%) пациентов фиброз печени регистрировали в стадии F0–F1 (табл. 1).
Средние значения кПа значимо отличались при стадиях фиброза F0–F1, F0–F2, F0–F4 и F2–F4. Это свидетельствует о том, что при последующем анализе взаимосвязи фиброза печени с генотипом ВГС, активностью АЛТ или длительностью инфицирования больных со стадией F0 можно рассматривать отдельно, а со стадиями F1–F2, F3–F4 – объединить.
Как видно из табл. 2, степень фиброза печени зависит от генотипа ВГС. Так, если больных ХГС с генотипом «не 1» и стадиями фиброза от F0 до F2 было 15 человек, то фиброз F3–F4 был выявлен только при генотипе 1 у 5 (22,7%) пациентов (p < 0,01).
Была проанализирована взаимосвязь активности процесса в печени по уровню АЛТ и степени фиброза. Из 17 больных с нормальной активностью АЛТ у 12 (70,6%) была выявлена стадия фиброза F0, но не выявлены пациенты со стадией F3–F4. И, наоборот, у больных с высокой активностью АЛТ фиброз в стадии F0 наблюдался только у 1 (12,5%) из 8 пациентов, в стадии F1–F2 – у 5 (62,5%) и в стадии F3–F4 – у 2 (25%). Исходя из этого, можно констатировать, что чем выше активность АЛТ, тем больше вероятность возникновения фиброза.
Наши данные согласуются с исследованиями О.О. Знойко [14], которая показала, что при нормальной активности ферментов печени не выявлено больных с быстрым формированием стадии фиброза F3, а при высокой активности АЛТ, независимо от продолжительности заболевания, в 17,9% случаев происходит быстрое формирование стадии F3.
 Частота встречаемости фиброза в стадии F3–F4 различалась в зависимости от длительности инфицирования (по данным эпидемиологического анамнеза) или сроков обнаружения анти-ВГС. В первом случае выраженный фиброз отсутствовал в первые 10 лет, и наоборот, при выявлении антител фиброз в стадии F3–F4 в 16,7% случаев диагностировали уже в первые 5 лет, в 11,1% случаев – в последующие 5 лет и в 14,2% случаев – при длительности гепатита свыше 10 лет.
Частота встречаемости фиброза в стадии F3–F4 различалась в зависимости от длительности инфицирования (по данным эпидемиологического анамнеза) или сроков обнаружения анти-ВГС. В первом случае выраженный фиброз отсутствовал в первые 10 лет, и наоборот, при выявлении антител фиброз в стадии F3–F4 в 16,7% случаев диагностировали уже в первые 5 лет, в 11,1% случаев – в последующие 5 лет и в 14,2% случаев – при длительности гепатита свыше 10 лет.
Таким образом, если обращать пристальное внимание на тщательный сбор данных эпидемиологического анамнеза, то можно раньше заподозрить и диагностировать ХГС и впоследствии предотвратить развитие фиброза печени своевременным назначением противовирусной терапии.
Таким образом, длительное наблюдение за больными с естественным течением ХГС, не получавшими противовирусной терапии, показало, что среди них преобладали пациенты молодого возраста (68,9%). Клиническая картина характеризовалась небольшим количеством симптомов: слабость – в 15,6% случаев, увеличение печени – в 31,1%, вторичные печеночные знаки – в 64,5%. Почти у половины (49%) больных отмечен нормальный уровень АЛТ, у большинства (76%) регистрировались стадия фиброза печени F0–F1 и высокая степень ВН только при генотипе 1 (68%). Выявлено, что степень ВН у больных с естественным течением ХГС выше при генотипе 1 и высоком уровне АЛТ.
Сроки постановки диагноза ХГС достоверно различались в зависимости от сроков выявления анти-ВГС и возможного заражения (по данным эпидемиологического анамнеза): по обнаружению антител сроки постановки диагноза запаздывали в среднем на 10 лет. Уровень АСТ оставался одинаковым в разные периоды наблюдения. Максимальная активность АЛТ, отражающая степень поражения печени как по ее выраженности, так и по удельному весу, приходилась на период от 5 до 10 лет заболевания. С увеличением длительности хронического процесса активность АЛТ уменьшалась даже при отсутствии противовирусной терапии.
Фиброз печени в стадии F3–F4 выявляли только у больных с умеренно повышенной и высокой (> 3N) активностью АЛТ и не наблюдали у пациентов с естественным течением ХГС при нормальным уровне АЛТ.
Поражение печени в виде выраженного фиброза в стадии F3–F4 было взаимосвязано со сроками инфицирования (по данным эпидемиологического анамнеза или по обнаружению анти-ВГС). В первом случае выраженный фиброз отсутствовал в течение 10 лет, и наоборот, если за точку отсчета брать сроки обнаружения антител, его выявляли уже в первые 5 лет от начала заболевания.
Таким образом, большое значение в течении ХГС и формировании фиброза печени имеют не столько длительность заболевания, сколько генотип вируса, степень ВН и активность гепатита, определяющие скорость развития фиброза.


