Возбудители менингококковой инфекции (МИ) – бактерии вида Neisseria meningitidis – различаются по вирулентным свойствам. Выделяемые при МИ штаммы не одинаковым образом вовлечены в эпидемический процесс, и не все штаммы способны вызывать генерализованные формы менингококковой инфекции (ГФМИ). Поэтому классификация возбудителей, вызывающих МИ, и определение возбудителей, способных вызывать ГФМИ, а также идентификация бактерий, способных вызывать эпидемические подъемы заболеваемости ГФМИ, являются важными задачами эпидемиологического мониторинга МИ [1–3].
Основной метод классификации бактерий вида N. meningitidis заключается в определении серогруппы капсульного полисахарида – одного из факторов вирулентности, позволяющего избегать неспецифического иммунного ответа и обеспечивать генерализацию инфекционного процесса. На основании химического состава полисахарида капсулы выделяют 12 серогрупп N. meningitidis, при этом ГФМИ вызывают представители серогрупп A, B, C, W, X и Y [4–6]. На территории России более чем 90% случаев ГФМИ обусловлены N. meningitidis серогрупп А, В и С, значительно реже – N. meningitidis серогруппы W [6–9], представители других серогрупп не представляют эпидемиологического интереса. Активная циркуляция N. meningitidis серогрупп W, X и Y характерна для разных зарубежных территорий [5, 6]. Антигены капсульного полисахарида А, С и W используются для выработки специфического иммунитета против возбудителей, поэтому информация о серогрупповом составе циркулирующих штаммов N. meningitidis вызывает исключительный эпидемиологический интерес при планировании иммунопрофилактических мероприятий и мониторинге их эффективности. В связи с этим первые схемы микробиологического мониторинга штаммов N. meningitidis, вовлеченных в эпидемический процесс МИ, были основаны на определении серогруппы капсульного полисахарида.
Исследования МИ на территории России (СССР) во второй половине XX века демонстрируют особенности течения эпидемического процесса МИ в зависимости от соотношения выделяемых от больных ГФМИ серогрупп N. meningitidis. Неоднократно опубликованные результаты этих наблюдений свидетельствуют об особой эпидемической опасности представителей N. meningitidis серогруппы A, которые выделялись на протяжении основных эпидемических подъемов заболеваемости [1–3, 8, 10–12]. В частности, в 1970-х годах было отмечено, что «связь серологической группы А с подъемами заболеваемости позволила ряду исследователей считать эти штаммы ”эпидемическими” ввиду их особо высокой вирулентности» [1], а также что «отдельные подъемы менингококковой инфекции в разных странах, связанные с серологическими группами В и С (Бельгия, США и др.), не достигали размаха эпидемий, вызванных менингококком группы А» [1]. В клинических наблюдениях были получены данные о повышенной вирулентности и высокой манифестности ГФМИ, вызванных представителями данной серогруппы, которая выражается в том, что «встреча с менингококками серогруппы А чаще заканчивается генерализованной формой болезни» [1, 11–13]. Несмотря на неоднократно описанную эпидемическую опасность N. meningitidis серогруппы А, данные наблюдения за эпидемическим процессом МИ в последние годы свидетельствуют о высокой (до 30%) доле циркулирующих на территории некоторых регионов России N. meningitidis серогруппы А, выделяемых от больных ГФМИ, на фоне тенденции к снижению заболеваемости [8, 14, 15], что может говорить о региональных особенностях циркулирующих штаммов.
В отличие от N. meningitidis серогруппы А, циркулирующие на территории России представители серогрупп В, С и W не были ассоциированы с эпидемическими подъемами заболеваемости, для них характерен спорадический характер заболеваемости. И в то же время было показано, что в разные периоды наблюдения за эпидемическим процессом МИ одним из предвестников осложнения эпидемической обстановки может являться увеличение числа случаев МИ, обусловленных N. meningitidis серогруппы В [13, 16–18]. Также было отмечено, что для штаммов N. meningitidis серогруппы В в разные годы была характерна разная эпидемическая активность, и в периоды относительного эпидемиологического благополучия между эпидемиями, вызванными N. meningitidis серогруппы А, преобладание серогруппы B было характерно в периоды как подъема, так и спада заболеваемости [8, 13, 16–18]. Различная интенсивность эпидемического процесса, обусловленного N. meningitidis серогруппы В, позволила предположить «наличие у этих микроорганизмов признака или комплекса признаков, которые коррелировали бы со степенью интенсивности эпидемического процесса» [16], что явилось основанием для выделения двух эпидемиологических типов МИ, обусловленной N. meningitidis серогруппы B, обозначенных как эпидемический и неэпидемический. Аналогично для эпидемического процесса, обусловленного N. meningitidis серогруппы С, которые также не были ассоциированы с эпидемическими подъемами заболеваемости, Н.П. Девяткина и соавт. [19] отмечали, что увеличение доли выделяемых от больных ГФМИ N. meningitidis серогруппы С является прогностически неблагоприятным признаком, особенно если заболеваемость регистрировалась среди подростков и взрослых.
Поскольку при наблюдении за эпидемическим процессом МИ представители одних и тех же серогрупп выделялись как в годы подъема, так и в годы спада заболеваемости, причем частота их выделения не всегда коррелировала с показателями заболеваемости [10, 13, 16, 17], еще в 1970-е годы отечественными эпидемиологами было высказано предположение о том, что помимо ведущей эпидемической опасности, исходящей от N. meningitidis серогруппы А, нельзя исключить «возможность существования высоковирулентных штаммов среди представителей других серогрупп» [11]. Аналогично для всех серогрупп N. meningitidis, ассоциированных со случаями ГФМИ за рубежом, была показана разная активность течения эпидемического процесса, не всегда связанная с иммунологическими или социальными параметрами наблюдаемых популяций [2, 3, 8, 11]. В частности, в зарубежных исследованиях неоднократно было показано, что некоторые представители N. meningitidis серогруппы W, как и N. meningitidis серогрупп В и С, способны вызывать эпидемический рост заболеваемости [2, 3, 20–22]. Несмотря на то что определение серогрупп N. meningitidis сохраняет важное значение при проведении эпидемиологического надзора за МИ [1, 7–9, 15, 19, 23], серогруппирование не во всех случаях позволяет прогнозировать эпидемические подъемы заболеваемости, а также, как было отмечено Н.Н Костюковой и соавт. [12], имеет «ограниченную ценность с эпидемиологических позиций, оно практически бесполезно при установлении связей между инфицированными лицами» (за исключением прогноза течения эпидемического процесса, обусловленного N. meningitidis серогруппы А).
Поэтому, исходя из предположения, что представители одних и тех же серогрупп N. meningitidis неодинаковым образом вовлечены в эпидемический процесс, были разработаны основанные на ПЦР молекулярно-биологические методики определения антигенных и генетических свойств возбудителей [3, 24, 25]. Основное эпидемиологическое значение имеют методики, обладающие дискриминирующей способностью, позволяющей дифференцировать штаммы, принадлежащие к одной серогруппе. Важное преимущество молекулярно-биологических методик заключается в возможности проведения характеристики нежизнеспособных возбудителей ГФМИ, что существенно снижает процент нерасшифрованных случаев заболеваний и тем самым увеличивает объем данных, используемых для проведения микробиологического мониторинга.
 Использование методик, предполагающих секвенирование фрагментов бактериального генома, позволяет проводить классификацию антигенных свойств и анализ генетических взаимоотношений штаммов однозначным образом и тем самым решать с помощью интернет-ресурсов проблемы, связанные с межлабораторной воспроизводимостью результатов. Результатом секвенирования является характеристика штамма на основании определенных нуклеотидных или соответствующих им аминокислотных последовательностей [3, 21, 25–27]. Современная рекомендованная Европейским обществом по изучению менингококковой инфекции (European Meningococcal Disease Society, www.emgm.eu) номенклатура обозначения штаммов N. meningitidis основана на определении антигенных (серогруппа, субтип, аллель фрагмента VR белка FetA) и генетических свойств штамма на основании данных мультилокусного секвенирования-типирования (МЛСТ) [25, 27–29]. Проведение МЛСТ заключается в определении по аллельному профилю из 7 фрагментов генов сиквенс-типа и принадлежности к клональному комплексу, обозначенному согласно принятой номенклатуре [30]. Если определить принадлежность штамма к известному клональному комплексу не удается, может быть проведен дополнительный анализ генетических взаимоотношений штаммов с использованием информации об известных сиквенс-типах. Результаты МЛСТ бактерий рода Neisseria объединяются в общедоступную базу данных http://pubmlst.org/neisseria/. Архитектура базы данных http://pubmlst.org/neisseria/ предполагает объединение информации об антигенных и генетических свойствах штаммов (изолятов), их источнике, времени и месте циркуляции, а также другой дополнительной информации [31, 32].
Использование методик, предполагающих секвенирование фрагментов бактериального генома, позволяет проводить классификацию антигенных свойств и анализ генетических взаимоотношений штаммов однозначным образом и тем самым решать с помощью интернет-ресурсов проблемы, связанные с межлабораторной воспроизводимостью результатов. Результатом секвенирования является характеристика штамма на основании определенных нуклеотидных или соответствующих им аминокислотных последовательностей [3, 21, 25–27]. Современная рекомендованная Европейским обществом по изучению менингококковой инфекции (European Meningococcal Disease Society, www.emgm.eu) номенклатура обозначения штаммов N. meningitidis основана на определении антигенных (серогруппа, субтип, аллель фрагмента VR белка FetA) и генетических свойств штамма на основании данных мультилокусного секвенирования-типирования (МЛСТ) [25, 27–29]. Проведение МЛСТ заключается в определении по аллельному профилю из 7 фрагментов генов сиквенс-типа и принадлежности к клональному комплексу, обозначенному согласно принятой номенклатуре [30]. Если определить принадлежность штамма к известному клональному комплексу не удается, может быть проведен дополнительный анализ генетических взаимоотношений штаммов с использованием информации об известных сиквенс-типах. Результаты МЛСТ бактерий рода Neisseria объединяются в общедоступную базу данных http://pubmlst.org/neisseria/. Архитектура базы данных http://pubmlst.org/neisseria/ предполагает объединение информации об антигенных и генетических свойствах штаммов (изолятов), их источнике, времени и месте циркуляции, а также другой дополнительной информации [31, 32].
Молекулярно-биологический мониторинг, осуществленный с применением антигенной характеристики в сочетании с МЛСТ, был с успехом применен в эпидемиологическом надзоре за МИ в зарубежных и отечественных исследованиях, посвященных изучению причин эпидемического подъема заболеваемости, и при проведении проспективного микробиологического мониторинга возбудителей ГФМИ [3, 7, 23, 29, 32–35]. Сотрудники Центрального НИИ эпидемиологии Роспотребнадзора (далее – ЦНИИЭ) метод МЛСТ для основных возбудителей гнойного бактериального менингита используют, начиная с 2000 г., результаты молекулярно-биологического мониторинга возбудителей регулярно публикуются в соответствующих базах данных (научные руководители исследований – д-р мед. наук И.С. Королева, д-р биол. наук, проф. А.Е. Платонов и канд. мед. наук Г.А. Шипулин). Для N. meningitidis был проведен анализ клональной структуры представителей основных серогрупп, вызвавших ГФМИ в Москве и на территории некоторых регионов России [7, 23, 26, 33, 36–40]. Помимо возбудителей ГФМИ значительная часть исследований была посвящена характеристике возбудителей в очагах МИ. В частности, в недавних исследованиях, проведенных в текущий межэпидемический период, результаты МЛСТ носительских штаммов N. meningitidis были использованы при классификации очагов ГФМИ в зависимости от активности эпидемического процесса. Предложенная Т.А. Максиной [41] (научный руководитель исследований – д-р мед. наук И.С. Королева) классификация очагов ГФМИ, согласно которой они делятся на очаги с низкой и высокой активностью течения эпидемического процесса, в зависимости от выявленных критериев, включающих, в том числе, характеристику генетических связей штаммов, выделенных от носителей и от больного, явилась основанием для оптимизации профилактических и противоэпидемических мероприятий в отношении МИ [23, 40–42].
Сегодня, несмотря на все многообразие применяемых молекулярно-биологических методов и большое количество публикаций, посвященных микробиологическому мониторингу с использованием альтернативных методик и их сочетаний [2, 3, 5, 21, 27, 34, 43, 44], а также постоянно растущий объем данных, получаемых в результате использования технологии массового параллельного секвенирования [5, 21, 43, 45, 46], данные о распространении клональных комплексов, обозначенных на основании МЛСТ, являются основным инструментом для идентификации новых и мониторинга циркуляции уже описанных штаммов N. meningitidis, принадлежащих основным серогруппам, ассоциированным с ГФМИ, или обладающих сниженными вирулентными свойствами [25, 27, 29, 30, 32, 47]. Принадлежность штамма N. meningitidis к определенному клональному комплексу отражает его эпидемический потенциал и с учетом других социально-биологических параметров течения эпидемического процесса позволяет прогнозировать эпидемическую ситуацию. Поэтому на современном этапе молекулярно-биологический мониторинг циркулирующих штаммов N. meningitidis, проводимый с помощью МЛСТ, является важным элементом эпидемиологического надзора за МИ.
Цель данного обзора – анализ результатов МЛСТ российских изолятов N. meningitidis, опубликованных в базе данных http://pubmlst.org/neisseria/, эпидемиологическая характеристика выявленных клональных комплексов и определение направлений дальнейшего молекулярно-биологического мониторинга для основных серогрупп возбудителей ГФМИ, циркулирующих на территории России.
База данных http://pubmlst.org/neisseria/ на момент написания обзора содержала 39 455 записей о представителях рода Neisseria, охарактеризованных методом МЛСТ. Из них 35 682 записей были отнесены к представителям вида N. meningitidis. Этому количеству изолятов соответствовало 10 864 сиквенс-типа, для которых было обозначено 52 клональных комплекса [30]. База данных http://pubmlst.org/neisseria/ содержала записи о 394 российских изолятах N. meningitidis. За редким исключением эти результаты МЛСТ были получены в рамках совместных исследований с зарубежными коллегами [34, 44, 48] и исследований, выполненных в ЦНИИЭ [26, 33, 36–42].
Клональные комплексы N. meningitidis, циркулирующие на территории России
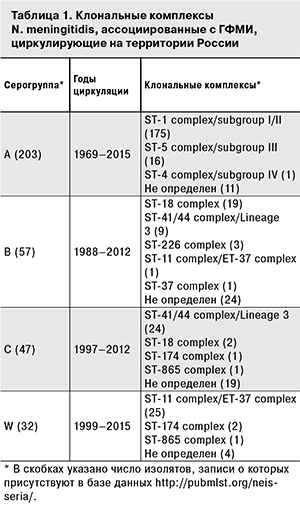
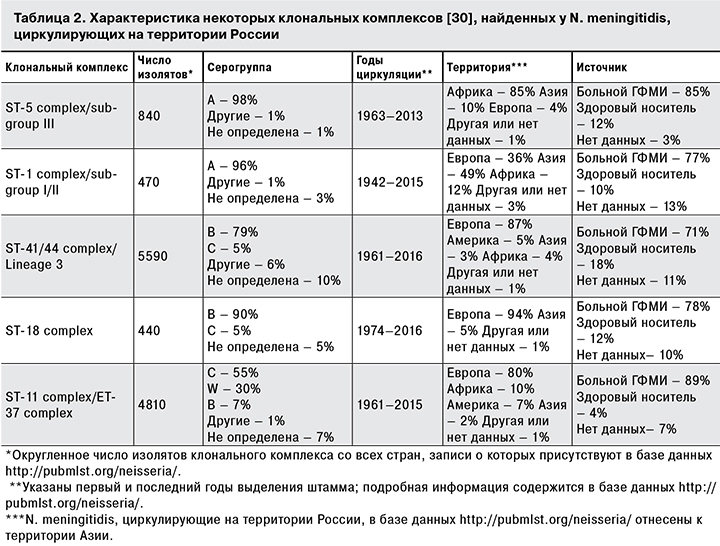
Клональные комплексы, найденные у изолятов N. meningitidis, циркулирующие на территории России, приведены в табл. 1. В табл. 2 представлена характеристика клональных комплексов N. meningitidis, которые чаще других были найдены на территории России, выполненная на основании информации, содержащейся в базе данных http://pubmlst.org/neisseria/. Табл. 2 объединяет данные генотипирования российских и зарубежных изолятов, выделенных от разных источников; более подробную информацию о клональных комплексах N. meningitidis можно найти в базе данных http://pubmlst.org/neisseria/.
N. meningitidis серогруппы А
Циркулирующие на территории России N. meningitidis серогруппы А отличает меньшее, по сравнению с N. meningitidis серогрупп B и C, разнообразие сиквенс-типов и клональных комплексов. Практически все охарактеризованные изоляты N. meningitidis серогруппы А неравномерно распределены по двум клональным комплексам. Выделение штаммов, не принадлежащих к описанным в базе данных http://pubmlst.org/neisseria/ клональным комплексам – достаточно редкое событие.
Клональный комплекс ST-5 complex/subgroup III (также обозначаемый как генетическая субгруппа III [39]) представляет собой гомогенную группу штаммов, образующую относительно немного генетических вариантов [2, 34, 39]. База данных http://pubmlst.org/neisseria/ содержит более 840 записей об изолятах, входящих в этот клональный комплекс, большая часть которых выделена на территории Африки. Наиболее часто у представителей данного клонального комплекса выделяются штаммы с сиквенс-типами ST-2859 (328 изолятов или 39%), ST-7 (320 изолятов или 38%) и ST-5 (127 изолятов или 15%), другие сиквенс-типы встречаются существенно реже – менее 1,5%.
Большинство последних эпидемий МИ были обусловлены представителями N. meningitidis серогруппы А, входящими в этот клональный комплекс на протяжении трех пандемических волн [2, 3, 29, 44, 46]. Первая пандемия началась в Китае (середина 1960-х годов), затем распространилась на страны Северной Европы (Россия и Скандинавия, с середины 1960-х годов) и Бразилию (середина 1970-х годов). Вторая пандемия началась в Китае и Непале (начало 1980-х годов). С 1987 г. штаммы генетической субгруппы III изолировались во время эпидемии в Саудовской Аравии, затем были распространены мусульманскими паломниками по многим странам Европы и Америки [2]. Третья волна пандемии также началась в Китае в начале 1990-х годов. С середины 1990-х годов она распространилась на Монголию, Россию и страны Африки [2, 34, 46]. В последующие годы штаммы генетической субгруппы III достигли Западной Европы и вызвали несколько случаев заболевания в Великобритании (1997–2000 гг.) [44].
В конце 2000-х годов в странах Африки наблюдалась активизация эпидемического процесса, ассоциированного со штаммами с сиквенс-типом ST-2859, возникшими в результате эволюции штаммов клонального комплекса ST-5 complex/subgroup III [46], что дополнительно подчеркивает особый эпидемиологический интерес к мониторингу циркуляции представителей этого клонального комплекса. В целом циркуляция штаммов, принадлежащих клональному комплексу ST-5 complex/subgroup III, характерна для территорий с неблагополучной эпидемической обстановкой, и выявление N. meningitidis этого клонального комплекса должно вызывать повышенную эпидемиологическую настороженность.
В отличие от клонального комплекса ST-5 complex/subgroup III, представители клонального комплекса ST-1 complex/subgroup I/II (на территории России он представлен генетическими субгруппами VI и X [39]) не ассоциированы с эпидемическими подъемами заболеваемости, следовательно, их выделение не является предвестником осложнения эпидемической обстановки. В то же время все N. meningitidis серогруппы A, выделяемые от больных ГФМИ, представляют повышенный эпидемиологический интерес, обусловленный многочисленными ретроспективными наблюдениями за течением эпидемического процесса на территории России [1, 7, 8, 10, 11, 16], что диктует необходимость постоянного молекулярно-биологического мониторинга. Мониторинг N. meningitidis серогруппы A, циркулирующих на территории Москвы в 1998–2015 гг., выявил отсутствие штаммов гипервирулентного клонального комплекса ST-5 complex/subgroup III, что согласуется с данными о невысоком уровне заболеваемости в эти годы. Спорадический характер заболеваемости на территории России ГФМИ, обусловленными N. meningitidis серогруппы A, объясняется циркуляцией представителей генетических субгрупп X и VI, входящих в клональный комплекс ST-1 complex/subgroup I/II, но редко встречающихся в иных регионах мира. Наблюдаемые эволюционные изменения у N. meningitidis серогруппы A выражались как в смене после 2002 г. преобладающей генетической субгруппы (с генетической субгруппы VI на генетическую субгруппу X), так и в смене после 2008 г. преобладающего сиквенс-типа внутри генетической субгруппы X (с сиквенс-типа ST-3339 на сиквенс-тип ST-75) [23, 39].
Несмотря на наблюдаемый в настоящее время спад заболеваемости, проведение молекулярно-биологического мониторинга N. meningitidis серогруппы A необходимо для предотвращения случаев возможного осложнения эпидемической обстановки. Основными направлениями микробиологического мониторинга должны стать наблюдение за относительной долей N. meningitidis серогруппы A, выделяемых от больных ГФМИ, проведение молекулярно-биологического мониторинга циркулирующих клональных комплексов, наблюдение за эволюционными изменениями внутри генетической субгруппы X и своевременное обнаружение представителей клонального комплекса ST-5 complex/subgroup III. Особое внимание эпидемиологам следует уделять изучению случаев ГФМИ, выявляемых у жителей азиатских и африканских стран, а также групповых случаев заболевания МИ, обусловленных N. meningitidis серогруппы A, входящих в клональные комплексы, роль представителей которых в эпидемическом процессе уже охарактеризована.
N. meningitidis серогрупп В и С
Значительное количество сиквенс-типов для N. meningitidis серогрупп В и С, выявленных в исследованиях [26, 33, 37, 40, 41], было найдено впервые, определить для них доминирующий сиквенс-тип не представляется возможным. Описание новых сиквенс-типов указывает на генетические особенности штаммов, циркулирующих на территории России и в то же время может свидетельствовать о недостатке информации, содержащейся в базе данных http://pubmlst.org/neisseria/ на начальном этапе отечественных исследований [33]. Несмотря на это для большинства охарактеризованных N. meningitidis серогрупп B и С, изолированных как от больных ГФМИ, так и от здоровых носителей, удается определить принадлежность к известному клональному комплексу [30], уже охарактеризованному зарубежными исследователями [21, 32, 35, 47]. Подобная ситуация – выявление не описанных ранее сиквенс-типов, входящих в известные клональные комплексы – также наблюдалась при проведении молекулярно-биологического мониторинга на сопредельной России территории – в Белоруссии (http://pubmlst.org/neisseria/ и [49]).
Как следует из табл. 1, примерно половина охарактеризованных N. meningitidis серогрупп В и С распределена между клональными комплексами ST-41/44 complex/Lineage 3 и ST-18 complex. Для штаммов серогруппы С характерна преимущественная принадлежность к клональному комплексу ST-41/44 complex/Lineage 3. На особенность российских N. meningitidis серогруппы С указывает отсутствие штаммов, принадлежащих клональному комплексу ST-11 complex/ET-37 complex – второму по частоте клональному комплексу, характерному для N. meningitidis, циркулирующих на территории Европы [21, 32, 35, 47].
Согласно информации, представленной в базе данных http://pubmlst.org/neisseria/, клональные комплексы ST-41/44 complex/Lineage 3 и ST-18 complex содержат преимущественно штаммы, выделяемые при ГФМИ. Для остальных клональных комплексов, определенных у российских N. meningitidis серогрупп B и С, наличие штаммов, выделенных при ГФМИ, менее характерно.
Клональный комплекс ST-41/44 complex/Lineage 3 включает наибольшее количество зарубежных штаммов (около 15% всех N. meningitidis, записи о которых присутствуют в базе данных http://pubmlst.org/neisseria/). Его представители были выделены практически во всех странах Западной Европы. Описаны эпидемические вспышки, вызванные штаммами клонального комплекса ST-41/44 complex/Lineage 3, на территории Европы и Америки в 1990-е годы [3, 32, 35]. Циркуляция на территории Европы N. meningitidis, принадлежащих клональному комплексу ST-18 complex, менее характерна, о чем свидетельствуют и меньшее количество изолятов (около 1% всех N. meningitidis, записи о которых присутствуют в базе данных http://pubmlst.org/neisseria/), и данные молекулярно-биологического мониторинга [32].
Несмотря на то что, согласно обозначению клональных комплексов в базе данных http://pubmlst.org/neisseria/, для 30 сиквенс-типов не удается определить известный клональный комплекс, молекулярно-биологический мониторинг, выполненный М.А. Королевой и соавт. [7, 37], позволил выявить на территории России циркуляцию группы генетически близких штаммов с сиквенс-типами ST-6926, ST-9396, ST-8499, ST-9400, ST-9405, ST-9569 и ST-10438. В предыдущих исследованиях в эту группу было включено 5 сиквенс-типов. В дальнейшем результаты молекулярно-биологического мониторинга и накопление данных МЛСТ позволили расширить эту группу и корректно обозначить центральный сиквенс-тип образованного клонального комплекса – ST-8499 (а не ST-9396, как сообщалось ранее [7, 37]). В клональный комплекс с центральным сиквенс-типом ST-8499, как и в клональные комплексы ST-41/44 complex/Lineage 3 и ST-18 complex, входят изоляты N. meningitidis серогрупп В и С. Все сиквенс-типы обозначенного клонального комплекса, за одним исключением, не были найдены на других территориях.
Одновременное присутствие нескольких клональных комплексов, а также выявление значительной доли штаммов, не объединенных в клональные комплексы, типично для спорадического характера заболеваемости в межэпидемический период. Циркуляция на наблюдаемой территории сиквенс-типов и клональных комплексов, выявленных в странах Европы, не позволяет говорить о существенных генетических отличиях российских штаммов N. meningitidis.
Поскольку идентификация известных представителей клональных комплексов является главной задачей молекулярно-биологического мониторинга N. meningitidis серогрупп B и C, и основная стратегия иммунопрофилактики заключается в контроле эпидемического процесса за счет элиминации только представителей капсульных гипервирулентных клональных комплексов [47], дальнейшие исследования должны заключаться в анализе генетических изменений, происходящих внутри выявленных клональных комплексов и группы генетически близких N. meningitidis c центральным сиквенс-типом ST-8499. Другим важным направлением молекулярно-биологического мониторинга является целенаправленная генетическая характеристика представителей этих серогрупп, циркулирующих на территориях с относительно высокой заболеваемостью. Ввиду высокого генетического разнообразия N. meningitidis серогрупп B и C по сравнению с серогруппами А и W важным элементом молекулярно-биологического мониторинга является своевременная публикация впервые обнаруживаемых аллелей и сиквенс-типов в совокупности с эпидемиологическими параметрами в базе данных http://pubmlst.org/neisseria/.
N. meningitidis серогруппы W
Для циркулирующих на территории России N. meningitidis серогруппы W, как и для представителей серогруппы А, характерна принадлежность к небольшому числу известных сиквенс-типов и клональных комплексов. Подавляющее большинство N. meningitidis серогруппы W входит в клональный комплекс ST-11 complex/ET-37 complex, который является вторым по объему клональным комплексом, характерным для зарубежных штаммов (содержит около 13% всех N. meningitidis, записи о которых присутствуют в базе данных http://pubmlst.org/neisseria/). N. meningitidis, принадлежащие этому клональному комплексу, исследователи ранее неоднократно выделяли во время эпидемических подъемов заболеваемости во многих странах мира, начиная 1990-х годов [2, 3, 20–22, 32, 47]. Штаммы с сиквенс-типом ST-11 также выявляли при вспышках МИ, нехарактерных для эпидемического процесса, обусловленного N. meningitidis [21, 50]. Наблюдаемая в течение многих лет невысокая частота выделения N. meningitidis серогруппы W от больных ГФМИ на территории России не позволяет говорить об эпидемической опасности циркулирующих штаммов и свидетельствует о спорадическом характере заболеваемости. Судя по всему, клональный комплекс ST-11 complex/ET-37 complex не является гомогенной группой штаммов [5], определяемой на основании МЛСТ, поскольку не исключено, что МЛСТ не обладает достаточной дискриминирующей способностью для выделения внутри этого клонального комплекса групп штаммов, имеющих разный эпидемический потенциал и обеспечивающих разный вклад в эпидемический процесс МИ. Это обстоятельство должно рассматриваться как повод для инициации дальнейших разработок молекулярно-биологических подходов, направленных на создание дополнительной классификации штаммов внутри клонального комплекса ST-11 complex/ET-37 complex с целью определения их роли в эпидемическом процессе.
В то же время сообщения об увеличении в последние годы доли N. meningitidis серогруппы W, выделенных от больных ГФМИ [36], а также другие эпидемиологические параметры, такие как повышение среднего возраста больных или увеличение количества N. meningitidis, принадлежащих клональному комплексу ST-11 complex/ET-37 complex, должны рассматриваться как вероятные предвестники ухудшения эпидемической ситуации.
В последние годы для большинства регионов России показатель заболеваемости ГФМИ не превышает 2 на 100 тыс. населения, в то же время и заболеваемость, и доля случаев гнойного бактериального менингита, обусловленных N. meningitidis, на разных территориях неодинаковы и могут существенно варьировать, как было показано ранее [7, 15, 18, 51]. В некоторых регионах России показатели заболеваемости ГФМИ могут превышать эпидемический порог и достигать высоких значений на уровне 7–8 и более на 100 тыс. населения [51], что обуславливает повышенный эпидемиологический интерес, который диктует необходимость проведения молекулярно-биологического мониторинга N. meningitidis, циркулирующих на этих и сопредельных территориях с целью идентификации циркулирующих клональных комплексов N. meningitidis и определения их роли в эпидемическом процессе. Особый эпидемиологический интерес представляет характеристика N. meningitidis, выделенных в очагах МИ, в рамках исследования возможных эпидемических вспышек и импортированных случаев заболевания [23, 34, 42]. Эпидемиологическую настороженность также должны вызывать сообщения о случаях активизации эпидемического процесса на сопредельных c Россией территориях. Поскольку главной целью молекулярно-биологического мониторинга является выявление циркуляции на территориях штаммов, обладающих повышенной эпидемической опасностью, основные направления исследований, проводимых в текущий межэпидемический период, должны заключаться в накоплении данных об антигенных и генетических свойствах штаммов N. meningitidis, вовлеченных в эпидемический процесс, и последующем проспективном анализе эпидемический ситуации.


