Лептоспирозы – это группа повсеместно распространенных природно-очаговых инфекций, известных на юге Дальнего Востока с середины прошлого столетия. В Амурской области в этот период заболевания отмечались с интервалом в несколько лет, в этиологии преобладали серогруппы Sejroe (Hebdomadis), Canicola и Australis. Среди населения Хабаровского края ежегодно регистрировалось до 50 случаев, возбудителями в основном являлись лептоспиры серогрупп Icterohaemorrhagiae и Canicola [1]. Эпидемический процесс в Приморском крае отличался более высокой интенсивностью с преобладанием групповых очагов и реже – крупных вспышек, преимущественно среди сельского населения [2]. В Еврейской автономной области только за 1951–1961 гг. описано 142 случая лептоспирозов, чаще вызванных лептоспирами Pomona. Однако с 70-х гг. ХХ века в результате урбанизации и оптимизации сельскохозяйственного труда отмечено значительное снижение заболеваемости, которая и до настоящего времени в основном представлена спорадическими случаями. Снижение активности эпидемического процесса привело к ослаблению внимания к этой инфекции, в то время как эпизоотологическая ситуация в природных очагах не изменялась.
В природных очагах юга Дальнего Востока циркуляции и размножению патогенных лептоспир способствуют благоприятные климатические условия: теплое циклоническое лето, плавно перетекающее в затяжную осень. Проливные дожди не раз приводили к разливам крупнейшей дальневосточной реки Амур и ее притоков с образованием неглубоких хорошо прогреваемых водоемов, которые в виде стариц или озер оставались и после спада уровня воды. Особую эпидемиологическую роль в распространении лептоспирозов имела развитая сеть оросительных каналов, в настоящее время большей частью заброшенных. Подобные места – влажные биотопы – являются естественной средой обитания мелких млекопитающих – основных резервуаров лептоспирозной инфекции.
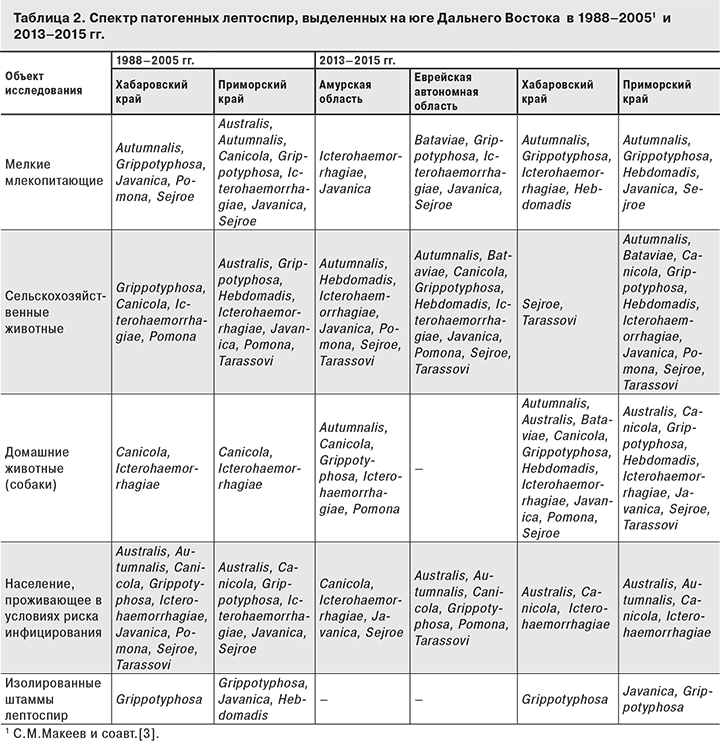
Проведенное в 1988–2005 гг. С.М. Макеевым с соавт. [3] районирование территории Дальнего Востока по показателям заболеваемости населения и величине иммунной прослойки позволило выделить 3 группы административных территорий: первая – со спорадической и групповой заболеваемостью (Владивосток, Хабаровск, Спасск-Дальний, Хабаровский район и др.), вторая – со спорадической заболеваемостью (Спасский, Ханкайский районы Приморского края и др.), третья – заболевания не регистрировались, но были выявлены лица, у которых результаты серологических исследований были положительными. Результаты эпизоотологического мониторинга свидетельствовали о циркуляции лептоспир серогрупп Australis, Canicola, Grippotyphosa, Icterohaemorrhagiae, Javanica и Sejroe в Приморском, Australis, Autumnalis, Canicola, Grippotyphosa, Icterohaemorrhagiae, Javanica, Pomona, Sejroe и Tarassovi – в Хабаровском краях.
В последние десятилетия существенное эпидемиологическое значение имеет широкое распространение возбудителя серогруппы Canicola с вовлечением в эпизоотический процесс сельскохозяйственных животных [4].
Цель работы – оценка современной ситуации по лептоспирозам на юге Дальнего Востока.
Материалы и методы
В работе использованы архивные материалы Референс-центра по мониторингу за природно-очаговыми болезнями Иркутского научно-исследовательского противочумного института Роспотребнадзора (Иркутский НИПЧИ), Управлений Роспотребнадзора по Приморскому и Хабаровскому краям, Амурской области, Еврейской автономной области, Приморской и Хабаровской противочумных станций. Проанализированы результаты планового эпизоотологического мониторинга территории Приморского и Хабаровского краев, Амурской области, Еврейской автономной области в 2014–2015 гг., а также результаты эпизоотолого-эпидемиологического мониторинга лептоспирозов на подтопленных территориях в период катастрофического паводка на реке Амур (2013), проведенного специализированными противоэпидемическими бригадами Иркутского НИПЧИ.
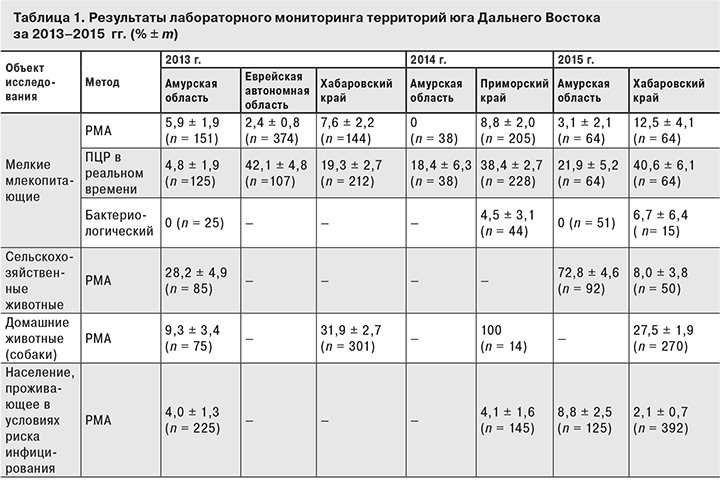
В лабораториях Иркутского НИПЧИ, Хабаровской и Приморской противочумных станций методами РМА и полимеразной цепной реакции (ПЦР) в реальном времени исследованы 887 сывороток крови людей, 927 – сельскохозяйственных и домашних животных, а также 1168 (РМА) и 943 (ПЦР) исследований материала от мелких млекопитающих.
РМА проводилась в соответствии с МУ 3.1.1128-02 с набором из 13 эталонных штаммов лептоспир. Выделение нуклеиновых кислот из почек мелких млекопитающих осуществляли комплектом реагентов для экстракции РНК/ДНК из клинического материала «АмплиПрайм РИБО-преп» (ООО «НекстБио», Москва), постановка ПЦР – с набором реагентов «Ампли-Сенс® Leptospira-FL» ПЦР-комплект вариант FRT (ФГУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва) на приборе Rotor-GeneQ («QIAGEN», Германия).
Посевы коркового вещества почек мелких млекопитающих производились на питательные среды Ферворта–Вольфа и Элленгаузена–МакКалоха в модификации Джонсона–Харриса – EMJH («Becton Dickinson», США), инкубировались при 28 °С в термостате и просматривались в темном поле микроскопа 1 раз в неделю в течение 3 мес. Серогрупповая принадлежность выделенных культур определялась в РМА с коммерческим «Набором сывороток групповых агглютинирующих лептоспирозных» («Армавирская биофабрика», Краснодарский край). Идентификацию культур до вида осуществляли методами прямого белкового профилирования и мультилокусного сиквенс-типирования, подготовку образцов и их последующий анализ проводили по протоколу для изолированных колоний [5] и общепринятой методике по схеме MLST [6]. Статистическую обработку результатов проводили стандартными методами непараметрической статистики с использованием t-критерия Стьюдента.
Результаты и обсуждение
В 2013 г. муссонные дожди и циклонические ливни привели к подтоплению обширных территорий Приамурья, что создало благоприятные условия для циркуляции патогенных лептоспир. В период паводка в Еврейской автономной области наблюдалась неблагоприятная эпизоотическая обстановка, на территориях Амурской области и Хабаровского края выявлен низкий уровень инфицированности мелких млекопитающих [7, 8]. Подобная тенденция продолжалась в 2014 г. в Амурской области (табл. 1). Следует отметить, что, согласно многолетним эпизоотологическим и ветеринарным наблюдениям, в области действуют малоактивные природные и сельскохозяйственные очаги лептоспирозов. Сход воды с паводковых территорий и проведенные полноценные противоэпидемические и дератизационные мероприятия [9] привели к восстановлению характерной эпизоотической картины в природных очагах лептоспирозов Еврейской автономной области в 2015 г. По данным ПЦР, инфицированность мелких млекопитающих только в Биробиджанском районе снизилась в 3,9 раза (с 79,2 ± 8,3 до 20,5 ± 6,5%; р < 0,01) в отличие от Хабаровского края, где прогноз на послепаводковый период 2014–2015 гг. [1, 10] практически полностью оправдался. В пригородной зоне Хабаровска инфицированность мелких млекопитающих превысила показатели 2013 г. (р < 0,01) в 7,1 раза по результатам ПЦР (5,3 ± 2,1 и 37,5 ± 6,5% соответственно) и в 1,9 раза – по результатам РМА (7,6 ± 2,2 и 14,3 ± 4,7%). От большой полевки выделена и идентифицирована методами прямого белкового профилирования и РМА с типовыми сыворотками патогенная культура Leptospira kirschneri серогруппы Grippotyphosa.
Лабораторное исследование материала от 333 мелких млекопитающих Приморского края подтвердило высокую инфицированность грызунов в природных очагах лептоспирозов Спасского и Ханкайского районов. Выделены культуры патогенных лептоспир от полевой мыши и большой полевки, в РМА установлена их принадлежность к серогруппам Javanica и Grippotyphosa, методом мультилокусного секвенирования – к видам L. borgpetersenii и L. kirschneri соответственно.
На территориях, пострадавших от паводка в 2013 г., среди мелких млекопитающих выявлена смена доминантной серогруппы Icterohaemorrhagiae на Grippotyphosa, которая более характерна для природных очагов Дальнего Востока.
В сыворотках крови сельскохозяйственных животных в 34,2 ± 2,5% случаев выявлены антитела к лептоспирам (см. табл. 1). Наличие антител к лептоспирам серогрупп Autumnalis, Bataviae, Hebdomadis, Icterohaemorrhagiae, Javanica указывает на возможное инфицирование в природных или антропургических очагах, местах водопоя и выпаса скота, а к лептоспирам серогрупп Grippotyphosa, Pomona, Sejroe и Tarassovi может свидетельствовать о поствакцинальном иммунитете. Обнаружение у сельскохозяйственных животных антител к лептоспирам серогруппы Canicola, является подтверждением их вовлечения в циркуляцию возбудителя «собачьего» лептоспироза. Результаты серологического скрининга получены в Амурской области как от крупного (22,8 ± 5,9%), так и от мелкого рогатого скота (32,0 ± 6,6%), в Приморском крае – от крупного рогатого скота из Спасского (80,0 ± 8,9%) и Ханкайского (65,0 ± 10,7%) районов в титрах от 1:20 до 1:400.
При серологическом скрининге 75 собак из Амурской области у 7 выявлены антитела к лептоспирам 5 серогрупп. В Приморском крае у 14 собак этиологическими агентами заболевания были лептоспиры 8 серогрупп. В Хабаровском крае обследована 571 собака с подозрением на лептоспироз, у 157 обнаружены антитела к лептоспирам 10 серогрупп (см. табл. 1), при этом в 2013 г. достоверно чаще выявляли лептоспиры серогруппы Icterohaemorrhagiae по сравнению с Canicola: 16,0 ± 2,1 и 10,3 ± 1,8% соответственно (n = 301; р < 0,05), тогда как до и после паводков в 2012, 2014, 2015 гг. доминировала серогруппа Canicola. Результаты мониторинга, проведенного Хабаровской противочумной станцией в 2005–2011 гг., подтверждают ведущую роль этих двух серогрупп в этиологии лептоспирозов у собак.
В Амурской области последние заболевания людей датируются 1994 г., в Еврейской автономной области – 1993, 1996 и 1998 г. В Хабаровском крае с 2003 по 2012 гг. отмечено 55 случаев лептоспироза, среднемноголетний показатель составил 0,381 0/0000. Основная часть заболевших зарегистрирована в Хабаровске и Хабаровском районе. За аналогичный период в Приморском крае зарегистрирован 21 случай лептоспироза среди людей (0,081 0/0000).
В 2013–2015 гг. в южных регионах Дальнего Востока зарегистрировано 9 случаев заболеваний лептоспирозом, из них 3 – в Хабаровском крае (диагноз установлен на основании обнаружения антител к лептоспирам серогрупп Icterohaemorrhagiae, Sejroe, Australis) и 6 – в Приморском (Icterohaemorrhagiae, Canicola, Sejroe). 2 случая закончились летальным исходом, 6 протекали в тяжелой форме. Заражение в основном происходило в местных природных и антропургических (городском и сельскохозяйственном) очагах при рыбной ловле, употреблении некипяченой воды из открытых водоемов, а также в результате несоблюдения правил личной гигиены при контакте с животными. Установлен 1 завозной случай лептоспироза из Таиланда.
На фоне отсутствия зарегистрированных заболеваний лептоспирозами при обследовании населения Амурской области и Еврейской автономной области обнаружены антитела к лептоспирам 4 и 5 серогрупп соответственно. В Еврейской автономной области у ветеринарных работников специфические антитела выявлялись достоверно чаще (24,0 ± 8,5 %), чем в случайной выборке здорового населения (5,0 ± 2,2 %; р < 0,01).
У жителей Хабаровского края в 2005–2009 гг. в 11,0–22,9% случаев определялись антитела к лептоспирам 7 серогрупп; за последние 3 года из 392 обследованных лиц, включая 13 ветеринаров, у 8 выявлены антитела к лептоспирам 3 серогрупп. Иммунная прослойка по сравнению с 2007 г. снизилась в 10 раз (р < 0,01).
Среди населения Приморского края продолжается циркуляция лептоспир 4 серогрупп, что подтверждает специфическая агглютинация в 6 из 145 проб (см. табл. 1), полученных от жителей Владивостока (2,0 ± 1,98%), Спасского (5,9 ± 3,3%) и Ханкайского (4,5 ± 3,1%) районов.
Обнаружение специфических антител к лептоспирам серогрупп Autumnalis, Grippotyphosa может указывать на инфицирование людей в природных очагах, Icterohaemorrhagiae и Canicola – в урбанизованных антропургических (городских, синантропных) очагах, Australis, Pomona и Tarassovi – в антропургических очагах сельскохозяйственного типа [11]. Подтверждается относительность гостальной специфичности лептоспир различных серогрупп: например, Canicola можно обнаружить не только у собак, но и у сельскохозяйственных животных и даже мелких млекопитающих.
Эпизоотолого-эпидемическая ситуация по лептоспирозам на юге Дальнего Востока, для которой характерны спорадические случаи заболевания людей и небольшой процент мелких млекопитающих с положительными результатами в РМА, с конца 80-х гг. существенно не меняется. Следует отметить, что этот метод ограничен набором эталонных штаммов и малоинформативен при носительстве, когда иммунный ответ может быть невыраженным, а при заболевании диагностические титры образуются спустя 2 недели после его начала. Однако внедрение в эпизоотологический мониторинг современных методов диагностики (ПЦР), отличающихся высокой специфичностью и возможностью определения ДНК патогенных лептоспир с первых дней инфицирования и на протяжении всего периода циркуляции возбудителя в организме, позволило установить реальный уровень инфицированности мелких млекопитающих.
Механизация сельскохозяйственного труда, внедрение в рабочий процесс средств индивидуальной защиты позволяют избегать прямого контакта с возможными источниками инфекции. Лептоспироз регистрируется только в тяжелых и среднетяжелых случаях, легкие формы заболевания не выявляются, что может быть следствием неспецифических проявлений, полиморфизма клинических симптомов и течением его под маской других инфекционных патологий. Немаловажную роль играет обилие и легкий доступ к лекарственным средствам, бесконтрольное применение которых в совокупности с вышеперечисленным значительно затрудняет диагностику лептоспироза. Согласно клинико-лабораторным исследованиям В.В. Лебедева и соавт. [12], проведенным у 446 больных иктерогеморрагическим лептоспирозом, находившихся на лечении в Городской инфекционной больнице Краснодара с 1981 по 1994 гг., соотношение тяжелых и среднетяжелых форм по отношению к легким составляет 18:1. Незначительные изменения серологического пейзажа лептоспирозов в течение ряда десятилетий (табл. 2), по нашему мнению, связаны с образованием стойких природных очагов со своей собственной экосистемой, патогенными микроорганизмами, их хозяевами и носителями, находящимися вне зоны урбанизации или активной сельскохозяйственной деятельности. При этом любое антропогенное или природное воздействие на подобные места может привести как к угасанию очага, так и наоборот, к его активизации и расширению границ.
Выводы
Для современной ситуации по лептоспирозам на юге Дальнего Востока характерны спорадические случаи заболевания людей преимущественно в тяжелой форме.
Обнаружение у населения антител к лептоспирам серогруппы Canicola на всех обследованных территориях свидетельствует о сохранении важной роли собак как источника инфекции. В этиологической структуре заболеваний населения Хабаровского края присутствуют лептоспиры серогруппы Australis, антитела к которым не обнаружены у мелких млекопитающих и сельскохозяйственных животных; у собак они выявлены в единичных случаях, что требует дальнейшего поиска возможных источников инфекции.
Во время паводка 2013 г. на подтопленных территориях доминировали лептоспиры серогруппы Icterohaemorrhagiae, после паводка возвращается тенденция к превалированию в природных очагах лептоспир серогруппы Grippotyphosa, а в антропургических – серогрупп Canicola и Icterohaemorrhagiae.
Эпизоотологическая обстановка в природных очагах лептоспирозов юга Дальнего Востока характеризуется неравномерностью. Так, в Амурской области она благополучна, в Еврейской автономной области заметна тенденция к снижению эпизоотической активности, тогда как в природных очагах Хабаровского и Приморского краев установлена высокая инфицированность мелких млекопитающих, что подтверждается выделением культур патогенных лептоспир.


