Ежегодно в мире регистрируется около 340 млн новых случаев инфекций, передающихся половым путем [1]. В качестве этиологических агентов таких инфекций в последнее время все более пристальное внимание привлекают вирусы. Наиболее часто в человеческой популяции встречаются герпесвирусы человека (ВГЧ) и вирусы папилломы человека (ВПЧ). Заболевания, вызванные ВГЧ и ВПЧ, характеризуются периодом первичного инфицирования с переходом в хронизацию (с персистенцией вируса) или в латенцию (с возможностью реактивации). В половых путях вирусы могут длительно персистировать без клинически выраженных проявлений, тогда как при первичном заражении, при реактивации и онкогенной трансформации – вызывать тяжелые заболевания, нередко с летальным исходом. У мужчин ВПЧ высокого канцерогенного риска (ВКР) ассоциируются с онкогенными заболеваниями – анальным и тестикулярным раком, раком полового члена [2]. Герпесвирусы – цитомегаловирус (ЦМВ), вирус Эпштейна–Барр (ВЭБ), ВГЧ 6-го и 8-го типов (ВГЧ-6, ВГЧ-8) – рассматриваются как кофакторы онкогенной трансформации. В то же время сведения о распространенности вирусов в урогенитальном тракте мужчин весьма противоречивы, а прогностическое значение присутствия вирусов при бессимптомном течении инфекции не определено.
В последнее десятилетие накапливаются данные о негативном влиянии вирусов на состояние репродуктивной системы мужчин [3–5], однако роль ВПЧ и ВГЧ в формировании бесплодия окончательно не доказана. Недостаточно данных также о роли ВПЧ и ВГЧ в развитии воспалительных заболеваний урогенитального тракта у мужчин. В то же время важность изучения этого вопроса очевидна, так как установлено, что хронические воспалительные заболевания урогенитального тракта являются одной из причин бесплодия [6].
Цель настоящего исследования – изучение распространенности ВГЧ и ВПЧ ВКР у мужчин с бесплодием неясной этиологии и у пациентов с инфекционно-воспалительными заболеваниями урогенитального тракта, а также анализ вирусной нагрузки в урогенитальном тракте и оценка влияния вирусов на качество спермы.
Материалы и методы
Изучен биологический материал от 605 мужчин, проходивших обследование в Медико-генетическом научном центре РАН, клинической больнице № 84 Федерального медико-биологического агентства России (Москва) и МСЧ № 170 Федерального медико-биологического агентства России (Москва) в 2013–2015 гг. Пациенты были распределены по 4 группам:
1-я группа (n = 180) – пациенты с бесплодием, страдающие хроническими воспалительными заболеваниями урогенитального тракта; средний возраст – 35,1 ± 8,2 года;
2-я группа (n = 82) – фертильные мужчины с воспалительными заболеваниями урогенитального тракта; средний возраст – 41,1 ± 8,7 года;
3-я группа (n = 175) – пациенты с идиопатическим бесплодием; средний возраст – 32,9 ± 6,8 года;
4-я группа – (n = 39) – практически здоровые фертильные мужчины, проходившие профилактическое обследование; средний возраст – 32,1 ± 7,5 года.
У всех пациентов 1-й и 2-й групп был установлен простатит, при этом у 133 из них – хронический простатит в стадии ремиссии и у 129 – хронический простатит в стадии обострения.
Диагноз хронического простатита был верифицирован согласно критериям NIH [7]. Для определения категории заболевания проводили микроскопическое и бактериологическое исследования до- и постмассажной пробы мочи. Бактериальным простатит считали в случаях, когда уропатогенный микроорганизм в постмассажной пробе выявляли в концентрации, более чем на порядок превышающей концентрацию в порции мочи, взятой до массажа предстательной железы. Тяжесть заболевания определяли с помощью индекса симптомов хронического простатита по версии Национального института здоровья США (NIH CPSI): легкая степень – 10–14 баллов, средняя – 15–29 баллов, тяжелая – более 30 баллов. Обострением хронического простатита считали возобновление симптомов заболевания длительностью более 3 мес. и тяжестью 10 и более баллов, ремиссией – наличие только клинических и/или лабораторных признаков заболевания без соответствующих жалоб.
Диагноз уретрита определяли согласно руководству Европейской ассоциации урологов (ЕАU) [8]. У пациентов 1-й и 3-й групп отмечали бесплодие, которое устанавливали, если после 12 мес. регулярной половой жизни без контрацепции у женщины не наступала беременность.
У всех пациентов были изучены образцы эякулята. Кроме того, отдельно были проведены исследования биологических образцов из урогенитального тракта (соскоб уретры, эякулят и сок простаты) от 129 пациентов с обострением хронического простатита без учета принадлежности к группе, так как сведения об их фертильности были недоступны.
До исследования от каждого пациента было получено информированное согласие на выполнение обследования. Процедуры проводили в соответствии с Хельсинкской декларацией, они были одобрены комитетом по биомедицинской этике Федерального научно-исследовательского центра эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи Минздрава России.
Образцы эякулята были получены пациентами путем мастурбации после 3-дневного полового воздержания. Образцы были разделены на 2 части: первую использовали для спермиологического анализа, вторую – для экстракции ДНК с последующим выявлением вирусной ДНК. Соскоб уретры производили путем введения зонда в канал уретры на глубину 3–4 см с помощью вращательных движений. Далее зонд извлекали и вносили в пробирку с транспортной средой. Затем пациенту предлагали частично помочиться с высвобождением 150–200 мл мочи. Забор секрета простаты производили с помощью пальцевого массажа железы сразу после мочеиспускания и удаления последней капли мочи из канала сухой стерильной салфеткой. Перед проведением массажа и после него в стерильные контейнеры брали по 10 мл мочи для проведения до- и постмассажной пробы по методу, описанному J.C. Nickel [9].
Спермиологическое обследование проводили согласно руководству ВОЗ [10]. Оценивали основные параметры спермограммы: объем спермы, концентрацию и степень подвижности сперматозоидов, а также количество морфологически нормальных форм.
ДНК ВПЧ ВКР в клиническом материале определяли методом ПЦР с помощью реагентов фирмы «ИнтерЛабСервис» (Москва): комплект реагентов для экстракции ДНК из клинического материала «АмплиСенс ДНК-сорб-В» и набор реагентов для выявления ДНК ВПЧ 12 генотипов вируса ВКР, относящихся к клайдам А9 (16, 31, 33, 35, 52, 58); А7 (18, 39, 45, 59); А5 (51) и А6 (56). Использовали набор для ПЦР «АмплиСенс® ВПЧ ВКР скрин-FL». Амплификацию проводили с помощью Rotor-Gene 6000 («Corbett Research», Австралия). При интерпретации количественных данных использовали рекомендации производителя тест-систем, разработанные для анализа ВПЧ в урогенитальных соскобах: концентрации ВПЧ ≤ 3 lg/105 клеток оценивали как клинически малозначимые; от 3 до 5 lg/105 клеток – как клинически значимые; > 5 lg/105 клеток – как клинически значимые с высоким риском развития дисплазии.
Для количественного определения ДНК ВЭБ, ЦМВ и ВГЧ-6 использовали набор реагентов для ПЦР в режиме реального времени – «АмплиСенсEBV/CMV/HHV6-cкрин-FL». β-глобиновый ген использовали в качестве эндогенного внутреннего контроля.
Для статистической обработки результатов использовали пакет прикладных компьютерных программ STATISTICA 6,0 и BIOSTAT. Статистические различия анализировали, применяя критерии Стьюдента и Манна–Уитни. Различия показателей считали статистически значимыми при р < 0,05.
Результаты и обсуждение
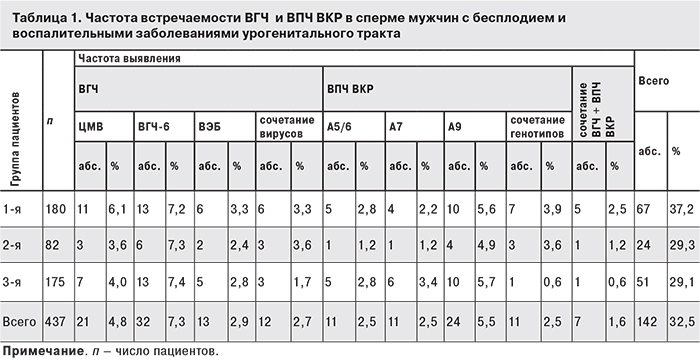
В 1-й–3-й группах ДНК ВПЧ ВКР и ВГЧ была выявлена в эякуляте у 142 (32,5%) пациентов (табл. 1). В образцах спермы, полученных в 4-й группе, ДНК этих вирусов не была обнаружена. Полученные данные показали, что присутствие каждого из изученных вирусов было относительно невелико. Среди ВГЧ при моноинфекции несколько чаще встречался ВГЧ-6 (7,3%), среди ВПЧ ВКР – генотипы А9 (5,5%), однако статистически значимые различия как между группами, так и между изученными вирусами выявлены не были (p > 0,05). Следует отметить, что около 3% образцов спермы содержали ДНК двух ВГЧ (ЦМВ + ВЭБ, ЦМВ + ВГЧ-6, ВГЧ-6 + ВЭБ) и приблизительно столько же – сочетания 2–3 ВПЧ ВКР разных генотипов, причем в сочетаниях чаще обнаруживали вирусы с генотипами А9. В нескольких образцах спермы (1,6%) были одновременно выявлены ДНК ВГЧ и ВПЧ ВКР (см. табл. 1). Суммарно сочетанная вирусная инфекция встречалась в 30 (6,9%) эякулятах.
Данные о частоте обнаружения ВГЧ в 437 эякулятах суммарно при моно- и сочетанных инфекциях как с другими ВГЧ, так и с ВПЧ ВКР показали, что ЦМВ был обнаружен в 29 (6,6%) эякулятах, ВГЧ-6 – в 45 (10,3%), ВЭБ – в 24 (5,5%), то есть тенденция в распределении вирусов сохранилась: ВГЧ-6 встречался чаще, чем ЦМВ и ВЭБ во всех группах, и в 1-й группе изучаемые ВГЧ были выявлены в относительно большем количестве, чем во 2-й и 3-й группах: в 41 (22,8%), 14 (17,1%) и 29 (16,5%) случаях. Однако обработка данных показала, что различия не достигают статистической значимости (р > 0,05). С учетом сочетанных инфекций 3 ВГЧ были обнаружены в 98 (22,4%) эякулятах.
Результаты анализа распространенности ВПЧ ВКР при моно- и сочетанных инфекциях показали, что в 1-й группе ВПЧ ВКР всех генотипов было выявлено больше, чем во 2-й и 3-й: соответственно 40 (22,2%), 13 (15,8%) и 25(14,2%), причем генотипы А9 превалировали во всех группах и суммарно составили 8,9%. Всего ВПЧ ВКР были выявлены в 78 (17,8%) эякулятах.
Представляло интерес и определение вирусной нагрузки в эякулятах обследованных пациентов. В каждой группе медианные значения для генотипов А9 статистически значимо превышали значения для генотипов A5/6 и A7 (р < 0,05). Суммарно концентрации ДНК ВПЧ ВКР статистически значимо различались в 1–3-й группах (р < 0,0001). Следует отметить большой разброс данных во всех группах: минимальные значения на 105 половых клеток составляли 2,2 копии ДНК, максимальные – 1 288 249 копий, что соответствует 6,11 lg. Клинически значимой концентрация ДНК ВПЧ ВКР оказалась в эякулятах пациентов 2-й группы: 2454,7 копии на 105 клеток (3,39 lg). В каждой группе были обнаружены пациенты, в эякулятах которых содержался ВПЧ ВКР в концентрациях, превышающих 3 lg/105 клеток. Среди 78 инфицированных пациентов таких оказалось 25 (32%).
Количественный анализ ДНК трех ВГЧ суммарно выявил значительную вариабельность значений: минимальное составило 1 копию/105 клеток, максимальное – 131 127 копий/105 клеток. Медианное значение по всем положительным образцам оказалось невысоким – 28 копий/105 клеток, при этом в 3-й группе оно было статистически значимо выше, чем в 1-й и во 2-й. Концентрация ДНК ЦМВ и ВГЧ-6 в 3-й группе была выше, чем в 1-й и 2-й (p < 0,0001), и среди ВГЧ ЦМВ встречался в большей концентрации, чем ВГЧ-6 и ВЭБ.
Дополнительно у 129 пациентов с обострением хронического простатита, не включенных 1–4-ю группы, было проведено исследование трех биологических образцов: 129 образцов из уретры, 115 – сока простаты, 83 – эякулята. Согласно международной классификации, у 7 из этих пациентов выявлен хронический бактериальный простатит (категория II). У 3 пациентов обнаружена Esсherihia coli 104–106 КОЕ/мл, у 2 – Enterococcus faecalis 104–108 КОЕ/мл 2, у 1 – Klebsiella oxytoca 107 КОЕ/мл и у 1 – Proteus mirabilis 105 КОЕ/мл. Вирусная ДНК была обнаружена у 40 (31%) пациентов в соскобе уретры, у 29 (34,9%) – в эякуляте, у 49 (42,6%) – в секрете простаты. Частота встречаемости ДНК изучаемых вирусов в секрете простаты и в соскобе из уретры статистически значимо не отличалась от таковой в эякуляте (p > 0,05). Следует отметить, что по крайней мере в одном из изученных клинических материалов вирусная ДНК была определена у 67 из 129 пациентов (51,9%), у 13,7% пациентов она выявлена во всех трех материалах.
Данные сравнительного анализа вирусной нагрузки показали, что медианные концентрации ДНК ВПЧ ВКР в эякуляте составили 2,8 lg/105 клеток, в соскобе из уретры – 3,5 lg/105 клеток и в секрете простаты – 2,8 lg/105 клеток (р > 0,05). Отметим, что у некоторых пациентов концентрация вируса была значительно выше 3 lg: у 14 пациентов – в соскобе из уретры, у 7 – в эякуляте, у 15 – в секрете простаты. У 6 из 57 (10,5%) ВПЧ ВКР-положительных пациентов концентрация вирусной ДНК превышала 5 lg, максимальная вирусная нагрузка была обнаружена в соскобе из уретры (6,31 lg/105 клеток).
При изучении концентрации ДНК ВГЧ у пациентов этой группы были получены сходные медианные значения: 2,3 lg/105 клеток – в эякуляте и в соскобе из уретры и 2,2 lg/105 клеток – в секрете простаты (р > 0,05). Отметим, среди ВГЧ максимальной концентрации достигал ВГЧ-6: в соскобе из уретры у одного из пациентов она составила 16 911 660 копий/мл или 7,23 lg, в секрете простаты – 6 683 160 копий/мл или 6,8 lg.
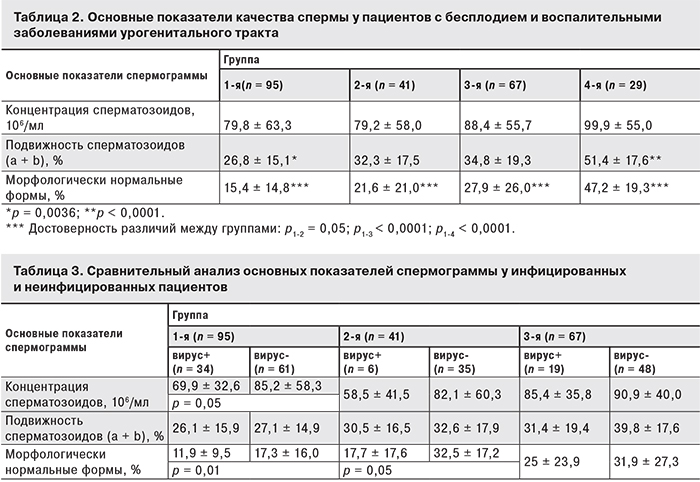
Для оценки влияния бесплодия и воспалительных заболеваний урогенитального тракта на основные показатели качества спермы был проведен статистический анализ спермограмм (табл. 2, 3). Было установлено, что средние показатели концентрации сперматозоидов в сперме пациентов 1–3-й групп не различались, тогда как подвижность половых клеток в эякулятах пациентов в 1-й группе была значительно ниже, чем в 3-й и 4-й группах, и показатель количества морфологически нормальных сперматозоидов в этой группе был меньше, чем в остальных (см. таб. 2).
Данные табл.3 показали, что у пациентов 1-й группы концентрация половых клеток в инфицированных эякулятах по сравнению с неинфицированными имела тенденцию к снижению (р = 0,05). Наиболее значимые изменения были обнаружены при подсчете морфологически нормальных форм сперматозоидов. Статистически значимые различия выявлены не только по средним показателям между 1-й и 2-й и 3-й группами, но и между инфицированными (вирус+) и неинфицированными (вирус-) эякулятами в 1-й и 2-й группах (р < 0,05). Показатели спермограмм в 4-й группе были значительно выше, чем в 1–3-й группах. По подвижности и морфологически нормальным клеткам различия между здоровыми мужчинами и пациентами в группах 1–3 были статистически значимыми (р < 0,0001).
Полученные данные показали, что у пациентов 1-й группы наблюдается снижение качества спермы практически по всем изученным показателям. Анализ инфицированных эякулятов позволил установить, что вирусная инфекция при воспалительных заболеваниях урогенитального тракта негативно влияет на морфологию зрелых половых клеток, причем как у пациентов с бесплодием, так и у фертильных мужчин.
ВПЧ ВКР и ВГЧ в эякулятах обнаружены почти у каждого третьего из 437 пациентов (32,5%), что значительно превышает данные G. Bezold и соавт. [11], изучавших сперму бессимптомных мужчин с бесплодием (18,7%), но ниже цифр, приведенных N. Kapranos и соавт. (56,6%) [3]. У пациентов с обострением хронического простатита по крайней мере в одном из изученных клинических материалов ДНК вирусов была выявлена в 51,9% случаев.
В структуре обнаруженных герпесвирусов при моно- и сочетанных инфекциях наиболее часто встречался ВГЧ-6 (суммарно у 10,3% пациентов), что почти в 3 раза превышает результаты, полученные другими авторами [11] при изучении спермы бессимптомных пациентов с бесплодием – 3,7%. Мы также чаще обнаруживали ВЭБ: суммарно при моно- и сочетанных инфекциях в 5,5% эякулятов против 0,4% в исследовании G. Bezold и соавт. [11]. ДНК ЦМВ суммарно выделена у 6,6% пациентов, что согласуется с результатами других исследователей [3, 11] – 8,7 и 7,1% соответственно.
ДНК ВПЧ ВКР в нашем исследовании обнаружена в эякулятах у 78 (17,8%) пациентов. Сходные данные приводят и другие исследователи [12, 13]. В то же время B. Gimenes и соавт. [14], исследовавшие в сперме ВПЧ не только высокого, но и низкого канцерогенного риска, получили иные данные – 38,1%. Повышенное содержание разных вирусов у пациентов с воспалительными заболеваниями урогенитального тракта может быть следствием нескольких причин. Во-первых, высокая половая активность при большом количестве половых партнеров создает возможность реинфекции. Кроме того, при хронических воспалительных заболеваниях развивается иммуносупрессия, благоприятствующая заражению новыми вирусами или реактивации латентной/персистентной инфекции. Наконец, молекулярно-эпидемиологические наблюдения указывают на возможность мутаций, происходящих, в частности, в геноме ВПЧ под действием как внешних, так и внутренних факторов, ответственных за разнообразие генотипов ВПЧ в урогенитальном тракте [15].
Как у мужчин, так и у женщин нередко обнаруживают сочетания вирусов, принадлежащих к разным семействам [16]. Однако мнения о влиянии сочетанных вирусных инфекций на онкогенез и тяжесть заболеваний урогенитального тракта различаются. В нашем исследовании у 6,9% пациентов в эякулятах обнаружены сочетанные вирусные инфекции, при этом у пациентов 1-й и 2-й групп чаще, чем в 3-й группе –10 и 8,5% против 2,8%. Это свидетельствует о большем влиянии сочетанных инфекций ВПЧ ВКР и ВГЧ на проявления клинически выраженных воспалительных заболеваний урогенитального тракта, чем на идиопатическое бесплодие.
Медианные значения концентрации ДНК ВПЧ ВКР и ВГЧ в эякулятах были относительно невысоки. В то же время концентрация ДНК ВПЧ ВКР у пациентов 2-й группы была выше и достигала клинически значимых величин: медиана составила 3,38 lg/105 клеток. При исследовании биологического материала у 8,9% ВПЧ-положительных пациентов концентрация вирусной ДНК превышала 5 lg. Выявление ВПЧ ВКР в концентрациях ≥ 5 lg10 может являться показателем высокого риска развития онкогенных заболеваний урогенитального тракта. Концентрация ДНК ВГЧ в эякулятах оказалась значительно ниже, чем ВПЧ ВКР, во всех группах. Более высокие суммарные значения медиан были обнаружены в 3-й группе (идиопатическое бесплодие). Анализ вирусной нагрузки по отдельным ВГЧ показал, что именно у пациентов с бесплодием ЦМВ встречался в более высоких концентрациях, чем ВГЧ-6 и ВЭБ. Присутствие инфекционных агентов бактериальной, вирусной и протозойной природы ассоциируется со снижением показателей спермы. У пациентов с ВИЧ-инфекцией, гепатитами В и С, папилломавирусной и ЦМВ-инфекцией снижены концентрация сперматозоидов и их подвижность [17]. Однако работ, в которых исследуется связь вирусных патогенов с мужским бесплодием, недостаточно. В связи с этим мнения авторов относительно воздействия вирусов на качество спермы остаются противоречивыми [11,18]. Нами на большом клиническом материале (в общей сложности проанализированы 205 спермограмм) было показано, что у пациентов с идиопатическим бесплодием снижены подвижность сперматозоидов и количество морфологически нормальных форм. При сочетании бесплодия и воспалительных заболеваний урогенитального тракта негативные изменения этих показателей выражены в еще большей степени.
Полученные результаты можно суммировать следующим образом:
- Более чем у 30% пациентов с бесплодием и воспалительными заболеваниями урогенитального тракта в биологических материалах (эякулят, соскоб из уретры, сок простаты) обнаруживаются ВГЧ и/или ВПЧ ВКР; при обострении хронического простатита хотя бы один из изученных вирусов встречается у каждого второго пациента.
- Около 30% пациентов имели вирусную нагрузку, превышающую 3 lg/105 клеток, что расценивается как клинически значимая концентрация ДНК. У 10% пациентов она превышала 5 lg/105 клеток, что свидетельствует о высоком риске неблагоприятного развития инфекции, в том числе онкогенеза.
- Имеется статистически значимое снижение подвижности сперматозоидов и уменьшение количества их морфологически нормальных форм у пациентов с бесплодием в сочетании с воспалительными заболеваниями урогенитального тракта.
В заключение следует отметить:
При снижении фертильности у мужчин герпесвирусная (в частности, ЦМВ) и папилломавирусная (ВПЧ ВКР) инфекции урогенитального тракта ассоциированы с негативными показателями качества спермы.
Рекомендуется вирусологическое обследование пациентов с бесплодием и воспалительными заболеваниями урогенитального тракта, а также образцов сперматозоидов в банках спермы, что позволит предотвратить возможную горизонтальную передачу вирусов половым партнерам и вертикальную – новорожденным.
Использование современных методов количественного анализа вирусов в урогенитальном тракте позволит разработать дополнительные диагностические критерии и усовершенствовать тактику лечения мужского бесплодия у лиц с хроническими вирусными инфекциями.


